Mangano oksidas (MnO2) Cheminė struktūra, savybės ir panaudojimas
The mangano oksidas (MnO2) yra neorganinis cheminis junginys, kurį sudaro elementas manganas su oksidacijos numeriu +4 ir deguonis, kuris oksidų susidarymo oksidacijos skaičius yra -2. Jis taip pat žinomas kaip mangano (IV) oksido ir mangano anhidrido pavadinimai.
Tai kieta nuo tamsiai iki juodos kavos. Jis yra kaip mineralinis piroluzitas, juodas ir kristalizuotas dendritas (šakotosios pailgos). Jį galima gauti kaip juodą liekaną reakcijoje tarp etileno ir kalio permanganato, susidarius glikoliui oksiduojančiu kalio permanganato poveikiu.

Tai labai svarbu stiklo pramonėje dėl savo oksiduojančios medžiagos pobūdžio, nes ji pašalina žalias spalvas, gaunamas iš juodųjų metalų junginių ir konvertuoja jas į juodąjį metalą..
Indeksas
- 1 Cheminė struktūra
- 2 Ypatybės
- 3 Naudojimas
- 3.1 Kaip katalizatorius
- 4 Poveikis sveikatai
- 5 Nuorodos
Cheminė struktūra
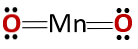
Cheminė junginio struktūra atitinka anhidrido, o ne bazinio oksido struktūrą, kaip tikėtasi, nes jis susideda iš metalo ir ne metalo..
Šis ypatingas atvejis yra dėl to, kad manganas elgiasi skirtingose oksidacijos būsenose. Tokiu būdu oksidacijos būsenos +2 ir +3 sudaro oksidus MnO ir Mn2O3 atitinkamai, kad reaguojant su vandeniu jie sudaro atitinkamai mangano hidroksidą ir mangano hidroksidą.
Tačiau Mn2O3 šiek tiek rūgštinėje terpėje jis veikia kaip anhidridas. Su oksidacijos būsena +4, +6 ir +7, MnO2, MnO3 ir MnO4 reaguojant su vandeniu jie susidaro rūgštys.
Šiek tiek rūgščioje terpėje MnO2 jis veikia kaip bazinis oksidas, todėl jis gali sudaryti atitinkamą hidroksidą.

Reikia nepamiršti, kad šiuo atveju nėra paminėta amfoterinių savybių, pagal kurias junginys gali veikti kaip rūgštis arba kaip pagrindas. Tai ypatingas Mn elgesio atvejis.
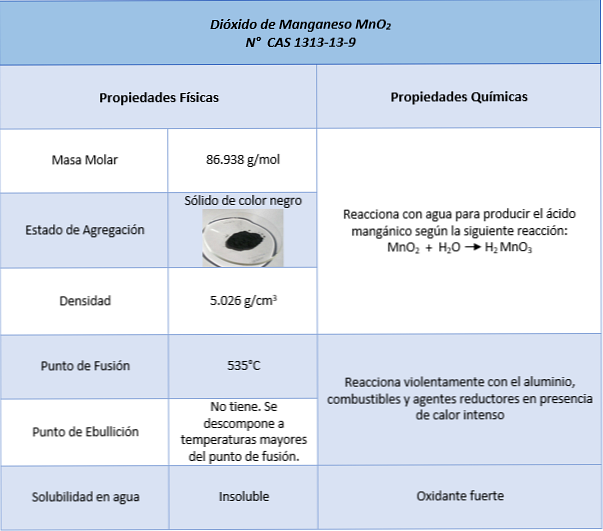
Savybės
Naudojimas
- Jis naudojamas kaip mangano šaltinis
- Kaip oksidatorius šarminėse baterijose
- Stiklo, keramikos ir porceliano dažai.
- Gaunant chlorą ir jodą.
- Skiriant vandenilio peroksidą deguonies ir vandens susidarymui.
- Kalio chlorato skilimo reakcijoje dujiniam deguoniui ir kalio chloridui gaminti.
- Ištirpintas acetone arba dichlormetane, oksiduoja pirminius alkoholius į aldehidus ir antrinius ketonus..
- Šarminių baterijų gamyba.
Kaip katalizatorius
Tai taikoma oksidų redukcijos reakcijoms, siekiant pašalinti sulfidus, tokius kaip H2S ir katijonai kaip Fe+2 ir Mn+2 , požeminio vandens arsenas ir radijas, užteršti šio tipo junginiais.
Šį užterštumą gali sukelti nekontroliuojamas toksinių medžiagų išmetimas, užteršto dirvožemio plovimas arba cheminių elementų buvimas vandens gavybos metu..
MnO2 Didžiausias grynumas, gaunamas iš pirolizito, naudojamo kaip filtras („Filox“), yra veiksmingiausia priemonė pašalinti šią požeminio vandens priemaišų klasę.
Poveikis sveikatai
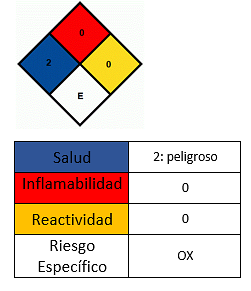
- Vengti patekimo ant odos.
- Patekus į kontaktą, nuplaukite atitinkamą plotą.
- Neįkvėpkite miltelių.
- Patekus į akis gali pasireikšti dirginimas ir paraudimas. Nuplaukite dideliu kiekiu vandens, palikite vandenį pro akis ir kreipkitės medicininės pagalbos, jei yra rimta.
- Patekus ant odos dirginimas ir paraudimas. Nuplaukite pažeistą vietą daug vandens ir muilu.
- Ilgalaikis sąlytis su oda pašalina jūsų natūralius riebalus, sukelia dermatitą.
- Įkvėpimas gali sukelti gripą panašią būklę (metalo dūmai). Būklė pasižymi aukšta karščiavimu, šaltkrėtis, burnos džiūvimu ir gerklėmis, raumenų skausmu ir galvos skausmu.
- Jis gali sudirginti kvėpavimo takus ir padidinti kvėpavimo takų infekcijų (pneumonijos) paplitimą. Neįtikėtina, kad neorganinė mangano druska absorbuojama per plaučius, tačiau gali pasireikšti lėtinis apsinuodijimas..
- Ilgalaikis mangano dioksido dulkių ar dūmų poveikis gali paveikti centrinę nervų sistemą ir sukelti Parkinsono ligos, vaikščiojimo sunkumų, raumenų spazmų ir elgesio pokyčių raidą..
- Nurijimas gali sukelti pilvo skausmą ir pykinimą.
- Jis nėra degus, bet padeda ugnies plitimui į kaitinamąsias medžiagas. Jei medžiaga kaitinama aukštesnėje kaip 535 ° C temperatūroje, medžiaga skaidosi į mangano oksidą (III) Mn2O3 ir deguonies, kuris yra degus ir padidina gaisro pavojų. Šiuo atveju gaisras turi būti užgesintas putomis arba anglies dioksidu.
- Išsiliejus, nekeiskite junginio be tinkamos asmeninės apsaugos.
- Laikykite junginį sandariai uždarytose talpyklose, šaltoje ir sausoje vietoje, toliau nuo nesuderinamų medžiagų, tokių kaip organinė medžiaga ir degi medžiaga.
- Sandėliavimo vieta turi būti sausa ir turėti grindų, atsparių rūgščiai korozijai ir geram drenažui..
- Turi būti naudojamos asmeninės apsaugos priemonės, pvz., Pirštinės, apsauginiai akiniai, anti-garų filtrų kaukės, dulkės ir dūmai.
Nuorodos
- B, (2015), Mangano dioksidas, Karališkoji chemijos draugija - chemijos pasaulis, išgautas iš chemistryworld.com
- Karal, (2014), Mangneso dioksidas, Saugos duomenų lapas, Atgautas iš, karal.com.mx
- Jūsų virtualus mokytojas (2015-02-25). Mangano neorganiniai junginiai (1 specifinis atvejis) - teorinė pamoka), gauta iš „youtube.com“
- Ecured, (s.f), mangano dioksidas, regeneruotas iš ecured.cu
- Angarita G, Johnny., (2017), mangano dioksidas: išskirtinė technologija. Hydrotec, susigrąžinta iš hidrotecocr.com
- Fernández, G., (2015), MnO mangano dioksidas2/ acetonas, Organinė chemija, Susigrąžinta iš quimicaorganica.net
- Tronox, (2011), mangano dioksidas, saugos duomenų lapas, susigrąžinta iš tronox.com


