Egzoterminės reakcijos procesas, tipai ir pavyzdžiai
The egzoterminė reakcija yra cheminės reakcijos rūšis, kurioje vyksta energijos perdavimas, daugiausia šilumos arba šviesos išsiskyrimo pavidalu. Pavadinimas kilęs iš Graikijos prefikso exo, tai reiškia „užsienyje“; ir terminas „terminis“, kuris reiškia šilumą ar temperatūrą.
Šia prasme egzoterminės reakcijos gali perduoti kitokios rūšies energiją į aplinką, kurioje jos yra sukurtos, pvz., Sprogimo būdu ir jų kinetinės ir garsinės energijos perdavimo būdą, kai padidėja dujinėje fazėje esančios medžiagos esant aukštai temperatūrai. smurtiniu būdu.
Tuo pačiu atveju, naudojant baterijas, taip pat atliekama egzoterminė reakcija, tik šiuo atveju transportuojama elektros energija..
Indeksas
- 1 Procesas
- 2 tipai
- 2.1 Degimo reakcijos
- 2.2 Neutralizacijos reakcijos
- 2.3 Oksidacijos reakcijos
- 2.4 Termito reakcija
- 2.5 Reakcijos polimerizacija
- 2.6 Branduolio dalijimosi reakcija
- 2.7 Kitos reakcijos
- 3 Pavyzdžiai
- 4 Nuorodos
Procesas
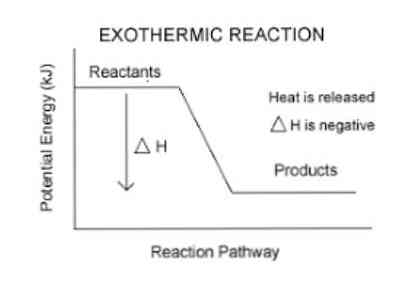
Anksčiau buvo paminėta, kad egzoterminės reakcijos metu atsiranda energijos išsiskyrimas, kuris gali būti lengviau matomas šioje lygtyje:
Reagentai → Produktas (-ai) + Energija
Taigi, norint kiekybiškai įvertinti sistemos absorbuotą ar išlaisvintą energiją, naudojamas termodinaminis parametras, vadinamas entalpija (žymimas „H“). Jei sistemoje (šiuo atveju cheminė reakcija) į aplinką patenka energija, tai entalpijos variacija (išreikšta ΔH) bus neigiama.
Priešingu atveju, jei šios priemonės kitimas yra teigiamas, jis atspindi šilumos absorbciją iš aplinkos. Be to, sistemos entalpijos variacijos dydis yra energijos kiekio, perkeliamo į aplinką arba iš jos, išraiška..
Kuo didesnis AH dydis, tuo didesnis energijos išleidimas iš sistemos į aplinkinę terpę.
Taip yra todėl, kad šiose reakcijose sukuriama grynoji energija, atsiradusi kuriant naujas sąsajas, yra didesnė už grynąją energiją, naudojamą ryšių susiskaidymui..
Iš to, kas išdėstyta pirmiau, galima daryti išvadą, kad tokios reakcijos yra labai dažni, nes reakcijos produktai turi energiją, saugomą jungtyse, kurios yra didesnės nei reaktyvuose..
Tipai
Yra įvairių egzoterminių reakcijų įvairiose chemijos srityse, tiek laboratorijoje, tiek pramonėje; kai kurie jų atliekami savaime, o kitiems reikalingos specifinės sąlygos arba tam tikros rūšies medžiaga, pvz., katalizatorius.
Toliau pateikiami svarbiausi egzoterminių reakcijų tipai:
Degimo reakcijos
Degimo reakcijos yra redokso tipo reakcijos, kurios atsiranda tada, kai viena ar kelios medžiagos reaguoja su deguonimi, o tai lemia šviesos ir šilumos energijos, ty šviesos ir šilumos, išsiskyrimą, kai susidaro liepsna..
Neutralizavimo reakcijos
Neutralizavimo reakcijoms būdinga rūgšties rūšies ir šarminės medžiagos (bazės) sąveika suformuojant druską ir vandenį, kuris pasireiškia egzoterminiu pobūdžiu..
Oksidacijos reakcijos
Yra daug šios rūšies reakcijų, kurios rodo egzoterminį elgesį, nes deguonies oksidacija sukelia didelį energijos kiekį, kaip tai įvyksta oksiduojant angliavandenilius..
Termito reakcija
Ši reakcija gali sudaryti maždaug 3000 ° C temperatūrą ir dėl didelio aliuminio miltelių su dideliu metalo oksidų kiekiu, jis naudojamas plieno ir geležies suvirinimui..
Polimerizacijos reakcija
Ši reakcija yra ta, kuri atsiranda tada, kai reaguoja tam tikras skaičius cheminių medžiagų, vadinamų monomerais, kurie yra vienetai, kurie kartu sujungiami grandinėse, sudarant makromolekulines struktūras, vadinamas polimerais..
Branduolio dalijimosi reakcija
Šis procesas reiškia, kad atomo, kuris laikomas sunkiu, ty, kai masės numeris (A) yra didesnis nei 200, padalijimas), siekiant gauti mažesnio dydžio fragmentus ar branduolius su vidutine masė.
Šioje reakcijoje, kur susidaro vienas ar daugiau neutronų, išsiskiria didelis energijos kiekis, nes didesnio svorio šerdis turi mažesnį stabilumą nei jo produktai.
Kitos reakcijos
Taip pat yra kitų labai svarbių egzoterminių reakcijų, pvz., Kai kurių angliavandenių dehidratacija reaguojant su sieros rūgštimi, vandens, kuriame yra atviras oras, absorbcija arba metalo rūšių oksidacija daugelyje korozijos reakcijų..
Pavyzdžiai
Žemiau yra keletas egzoterminių reakcijų, kurios sukuria entalpijos kitimą, turinčią neigiamą vertę dėl to, kad jos išskiria energiją, kaip minėta pirmiau, pavyzdžių..
Pavyzdžiui, propano deginimas yra savaiminė egzoterminė reakcija:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O (l)
Kitas egzoterminio elgesio atvejis parodo neutralizavimo reakciją tarp natrio karbonato ir druskos rūgšties:
NaHCO3(ac) + HCl (ac) → NaCl (ac) + H2O (l) + CO2(g)
Taip pat pateikiama etanolio oksidacija į acto rūgštį, naudojamą kvėpavimo aparatuose, kurių visa reakcija parodyta šioje lygtyje:
3CH3CH2OH + 2K2Kr2O7 + 8H2SO4 → CH3COOH + 2Cr (SO4)3 + 2K2SO4 + 11H2O
Kita egzoterminės reakcijos klasė yra vadinamoji termitinė reakcija, kurioje aliuminis yra derinamas su metalo oksidu, kaip parodyta toliau:
2Al (s) + Tikėjimas2O3→ Al2O3(s) + Fe (l)
Be pirmiau paaiškintų pavyzdžių, yra daug įvairių reakcijų, kurios taip pat laikomos egzoterminėmis, pavyzdžiui, tam tikrų organinių atliekų kompostavimui..
Jame taip pat pabrėžiamas luciferino pigmento oksidavimas luciferazės fermentu veikiant, kad būtų sukurta daugybė kitų reakcijų, kurios būdingos fireflies, ir net kvėpuoja..
Nuorodos
- Vikipedija. (s.f.). Eksoterminė reakcija. Gauta iš es.wikipedia.org
- BBC (s.f.). Energijos pokyčiai ir grįžtamos reakcijos. Gauta iš bbc.co.uk
- Chang, R. (2007). Chemija, devintas leidimas. (McGraw-Hill).
- Walker, D. (2007). Cheminės reakcijos. Gauta iš books.google.co.ve
- Saunders, N. (2007). Cheminių reakcijų tyrimas. Gauta iš books.google.co.ve


