Endoterminės reakcijos charakteristikos, lygtys ir pavyzdžiai
Vienas endoterminė reakcija tai, kas turi vykti energijos absorbavimui šilumos ar spinduliuotės pavidalu. Paprastai, nors ne visada, juos galima atpažinti dėl to, kad jų aplinka sumažėja; priešingai, jiems reikia šilumos šaltinio, panašaus į tą, kuris gaunamas degančia liepsna.
Energijos ar šilumos absorbcija yra bendra visų endoterminių reakcijų; Tos pačios rūšys, kaip ir susijusios transformacijos, yra labai įvairios. Kiek šilumos jie turėtų sugerti? Atsakymas priklauso nuo jo termodinamikos: temperatūra, kurioje reakcija vyksta savaime.

Pavyzdžiui, viena iš simbolinių endoterminių reakcijų yra valstybės pasikeitimas iš ledo į skystą vandenį. Ledas turi sugerti šilumą, kol jo temperatūra pasiekia maždaug 0 ° C; tuo metu jo lydymas tampa spontaniškas, o ledas sugeria, kol visiškai ištirps.
Karštose vietose, pavyzdžiui, paplūdimio krante, temperatūra yra aukštesnė, todėl ledas greičiau sugeria šilumą; tai yra, jis lydosi didesniu greičiu. Ledynų lydymas yra nepageidaujamos endoterminės reakcijos pavyzdys.
Kodėl taip atsitinka? Kodėl ledas negali būti pateikiamas kaip karštas kietas? Atsakymas slypi vidutinėje vandens molekulių kinetinėje energijoje abiejose valstybėse ir kaip jie tarpusavyje sąveikauja per vandenilio ryšius.
Skystame vandenyje jo molekulės turi didesnę judėjimo laisvę nei lede, kur jų kristaluose jie vibruoja. Norėdami judėti, molekulės turi sugerti energiją taip, kad jų vibracijos sulaužytų stiprius vandenilio tiltus lede.
Dėl šios priežasties ledas sugeria šilumą, kad ištirptų. Norint, kad būtų „karštas ledas“, vandenilio tiltai turėtų būti neįprastai stiprūs, kad jie ištirptų esant aukštesnei nei 0 ° C temperatūrai..
Indeksas
- 1 Endoterminės reakcijos savybės
- 1,1 ΔH> 0
- 1.2 Atvėsinkite savo aplinką
- 2 lygtys
- 3 Dažniausių endoterminių reakcijų pavyzdžiai
- 3.1 Sauso ledo garavimas
- 3.2 Duonos kepimas ar maisto ruošimas
- 3.3 Saulės deginimas
- 3.4 Atmosferos azoto ir ozono susidarymas
- 3.5 Vandens elektrolizė
- 3.6 Fotosintezė
- 3.7 Kai kurių druskų tirpalai
- 3.8 Terminis skaidymas
- 3.9 Amonio chloridas vandenyje
- 3.10 Natrio triosulfatas
- 3.11 Automobilių varikliai
- 3.12 verdantys skysčiai
- 3.13 Kiaušinio virimas
- 3.14 Maisto ruošimas
- 3.15 Maisto šildymas mikrobangų krosnelėje
- 3.16 Stiklo liejimas
- 3.17 Žvakės vartojimas
- 3.18 Valymas karštu vandeniu
- 3.19 Maisto ir kitų objektų šiluminė sterilizacija
- 3.20 Kova su karščiavimu
- 3.21 Vandens garavimas
- 4 Nuorodos
Endoterminės reakcijos charakteristikos
Valstybės pasikeitimas nėra tinkamai cheminė reakcija; tačiau tas pats atsitinka: produktas (skystas vanduo) turi daugiau energijos nei reaktantas (ledas). Tai yra pagrindinė reakcijos ar endoterminio proceso savybė: produktai yra energingesni nei reagentai.
Nors tai tiesa, tai nereiškia, kad produktai turi būti nestabilūs. Esant tokiai situacijai, endoterminė reakcija nustoja būti spontaniška visomis temperatūros ar slėgio sąlygomis.
Apsvarstykite šią cheminę lygtį:
A + Q => B
Kai Q reiškia šilumą, paprastai išreiškiamas džaulių (J) arba kalorijų (cal) vienetais. Kadangi A sugeria šilumą Q, kad transformuotųsi į B, tada sakoma, kad tai yra endoterminė reakcija. Taigi, B turi daugiau energijos nei A ir turi sugerti pakankamai energijos, kad pasiektų transformaciją.
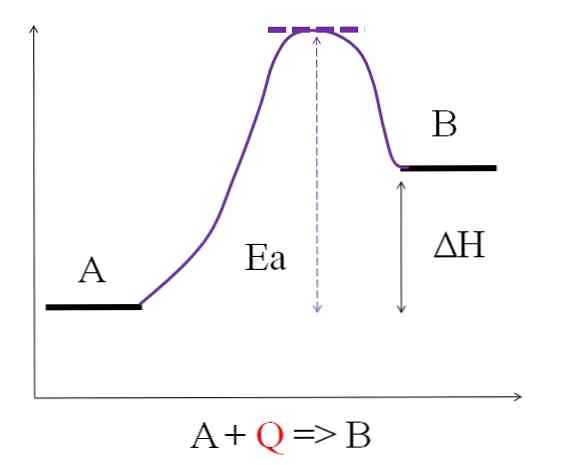
Kaip matyti iš aukščiau pateiktos diagramos, A turi mažiau energijos nei B. A absorbuojantis šilumos kiekis Q yra toks, kad jis įveikia aktyvinimo energiją (energiją, reikalingą purpuriniam viršūnui pasiekti su taškiniu stogu). Energijos skirtumas tarp A ir B yra tai, kas žinoma kaip reakcijos entalpija, AH.
ΔH> 0
Visos endoterminės reakcijos turi bendrą ankstesnę schemą, nes produktai yra energingesni nei reagentai. Todėl energijos skirtumas tarp jų, ΔH, visada yra teigiamas (HProduktas-HReagentas > 0). Kai tai tiesa, reikia, kad šiluma ar energija būtų absorbuota iš aplinkos, kad būtų tiekiamas šis energingas poreikis.
Kaip aiškinamos tokios išraiškos? Cheminėse reakcijose ryšiai visuomet yra sugadinti, kad būtų sukurti kiti. Norint juos sulaužyti, reikalingas energijos įsisavinimas; tai yra, endoterminė ištrauka. Tuo tarpu ryšių formavimas reiškia stabilumą, todėl tai yra egzoterminis žingsnis.
Kai susidariusios jungtys nesuteikia stabilumo, panašaus į energijos kiekį, reikalingą senosioms grandinėms nutraukti, tai yra endoterminė reakcija. Štai kodėl reikia papildomos energijos, kad būtų skatinamas stabiliausių reagentų ryšys.
Kita vertus, egzoterminėse reakcijose atsitinka priešingai: šiluma išsiskiria ir ΔH yra < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Jie atvėsina aplinką
Nors tai netaikoma visoms endoterminėms reakcijoms, keletas jų sumažina aplinkos temperatūrą. Taip yra todėl, kad sugeriama šiluma ateina iš kažkur. Todėl, jei A ir B konversijos būtų perkeltos į konteinerį, jis atvės.
Kuo labiau endoterminė reakcija, tuo šaltesnis konteineris ir jo apylinkės taps. Iš tiesų, kai kurios reakcijos netgi gali sudaryti ploną ledo dangą, tarsi jie būtų išėję iš šaldytuvo.
Tačiau yra tokių tipų reakcijų, kurios neatsisako savo aplinkos. Kodėl? Kadangi aplinkos šiluma yra nepakankama; tai reiškia, kad ji nesuteikia būtino Q (J, cal), kuris yra parašytas cheminėmis lygtimis. Todėl čia įeina gaisras arba ultravioletinė spinduliuotė.
Tarp abiejų scenarijų gali atsirasti nedidelė painiava. Viena vertus, apylinkės šilumos pakanka, kad reakcija vyktų savaime, ir stebimas aušinimas; kita vertus, reikia daugiau šilumos ir naudojamas efektyvus šildymo metodas. Abiem atvejais tas pats vyksta: energija sugeria.
Lygtis
Kokios yra atitinkamos lygtys endoterminėje reakcijoje? Kaip jau buvo paaiškinta, ΔH turi būti teigiamas. Norėdami ją apskaičiuoti, pirmiausia laikoma ši cheminė lygtis:
aA + bB => cC + dD
Kur A ir B yra reaguojančios medžiagos, o C ir D yra produktai. Mažosios raidės (a, b, c ir d) yra stechiometriniai koeficientai. Norint apskaičiuoti šios bendros reakcijos ΔH, taikoma tokia matematinė išraiška:
ΔHProduktai- ΔHReagentai = ΔHrxn
Jūs galite pereiti tiesiogiai arba atlikti skaičiavimus atskirai. ΔHProduktai turi būti apskaičiuota ši suma:
c ΔHfC + d ΔHfD
Kur ΔHf tai yra kiekvienos į reakciją įtrauktos medžiagos formavimo entalpija. Pagal susitarimą, jų stabiliausios formos medžiagos turi ΔHf= 0 Pavyzdžiui, O molekulės2 ir H2, arba kietas metalas, jie turi ΔHf= 0.
Tas pats skaičiavimas atliekamas ir reagentams, ΔHReagentai:
iki ΔHfA + b ΔHfB
Bet kaip lygtis sako, kad ΔHReagentai turi būti atimta iš ΔHProduktai, tada ankstesnė suma turi būti padauginta iš -1. Taigi turite:
c ΔHfC + d ΔHfD - (iki ΔHfA + b ΔHfB)
Jei šio skaičiavimo rezultatas yra teigiamas skaičius, tai yra endoterminė reakcija. Ir jei tai neigiama, tai egzoterminė reakcija.
Dažniausių endoterminių reakcijų pavyzdžiai
Sauso ledo garavimas

Kas matė tuos baltus garus iš ledų krepšelio, matė vieną iš labiausiai paplitusių endoterminės "reakcijos" pavyzdžių..
Be kelių ledų, šie garai, atsiskiriantys nuo kieto balto, vadinami sausu ledu, taip pat buvo vienas iš scenarijų, siekiant sukurti miglos poveikį. Šis sausas ledas yra tik kietas anglies dioksidas, kuris sugeria temperatūrą ir prieš pradėdamas sublimuoti išorinį slėgį.
Vaiko auditorijos eksperimentas būtų užpildyti ir užsandarinti maišelį su sausu ledu. Po kurio laiko jis bus pripučiamas dėl CO2 dujinis, kuris sukuria darbą arba spaudžia vidines maišelio sienas nuo atmosferos slėgio.
Kepinių kepimas arba maisto ruošimas

Duonos kepimas yra cheminės reakcijos pavyzdys, nes dabar dėl karščio yra cheminių pokyčių. Kas kvepia šviežiai iškeptų duonos aromatą, žino, kad vyksta endoterminė reakcija.
Tešlai ir visos jos sudedamosios dalys, reikalingos krosnies šilumai, kad galėtų atlikti visas transformacijas, kurios būtinos norint tapti duona ir pasižymėti būdingomis savybėmis.
Be duonos, virtuvė yra pilna endoterminių reakcijų pavyzdžių. Kas virėjai dirba su jais kasdien. Makaronų gaminimas, grūdų minkštinimas, kukurūzų grūdų šildymas, kepimo kiaušiniai, prieskonių mėsa, kepimo kepimas, arbatos paruošimas, sumuštinių šildymas; kiekviena iš šių veiklų yra endoterminės reakcijos.
Dienos deginimas

Kaip paprasta ir bendra, kaip atrodo, saulės vonios, kurias imasi tam tikri ropliai, pavyzdžiui, vėžliai ir krokodilai, patenka į endoterminių reakcijų kategoriją. Vėžliai sugeria saulės šilumą, kad reguliuotų jų organizmo temperatūrą.
Be saulės, jie išlaiko vandens šilumą, kad išliktų šiltas; kas baigiasi vandens aušinimu jūsų talpyklose ar žuvų talpyklose.
Atmosferos azoto ir ozono susidarymas

Orą daugiausia sudaro azotas ir deguonis. Per perkūnijas išsiskiria energija, kuri gali sulaužyti stipriąsias jungtis, turinčias azoto atomus kartu su N-molekule.2:
N2 + O2 + Q => 2NO
Kita vertus, deguonis gali absorbuoti ultravioletinę spinduliuotę, kad ji taptų ozonu; deguonies allotropas, kuris yra labai naudingas stratosferoje, bet kenkia gyvenimui žemėje. Reakcija yra:
3O2 + v => 2O3
Kur v reiškia ultravioletinę spinduliuotę. Šis paprastos lygties mechanizmas yra labai sudėtingas.
Vandens elektrolizė
Elektrolizė naudoja elektros energiją, skirtą molekulei atskirti savo elementuose arba formuoti molekules. Pavyzdžiui, vandens elektrolizėje susidaro dvi dujos: vandenilis ir deguonis, kiekvienas iš jų yra skirtingi elektrodai:
2H2O => 2H2 + O2
Be to, natrio chloridas gali patirti tą pačią reakciją:
2NaCl => 2Na + Cl2
Viename elektrode pamatysite metalo natrio formavimąsi, o kitose - žalsvus chloro burbulas.
Fotosintezė

Augalai ir medžiai turi įsisavinti saulės šviesą kaip energijos tiekimą, kad sintezuotų jų biomedžiagas. Tam ji naudoja CO kaip žaliavą2 ir vanduo, kuris per ilgą žingsnių seką paverčiamas į gliukozę ir kitus cukrus. Be to, susidaro deguonis, kuris išsiskiria iš lapų.
Kai kurių druskų tirpalai
Jei natrio chloridas yra ištirpintas vandenyje, pastebimas laivo ar konteinerio išorinės temperatūros pokytis nebus pastebimas..
Kai kurios druskos, tokios kaip kalcio chloridas, CaCl2, padidinti vandens temperatūrą, kaip didelio Ca jonų hidratacijos rezultatą2+. Ir kitos druskos, tokios kaip nitratas arba amonio chloridas, NH4NE3 ir NH4Cl, sumažinkite vandens temperatūrą ir atvėsinkite aplinką.
Klasėse paprastai atliekami naminiai eksperimentai, ištirpinant kai kurias iš šių druskų, kad būtų parodyta, kas yra endoterminė reakcija.
Temperatūros sumažėjimas atsirado dėl NH jonų hidratacijos4+ tai nepalanki kristalinių jo druskų sudėties ištirpinimui. Todėl druskos absorbuoja šilumą iš vandens, kad jonai būtų solvuojami.
Kita cheminė reakcija, kuri paprastai yra labai paplitusi, kad būtų įrodyta, yra tokia:
Ba (OH)2· 8H2O + 2NH4NE3 => Ba (NO3)2 + 2NH3 +10H2O
Atkreipkite dėmesį į susidariusio vandens kiekį. Sumaišius abi kietas medžiagas, gaunamas vandeninis Ba tirpalas (NO3)2, su amoniako kvapu ir tokiu temperatūros kritimu, kuris tiesiog užšaldo išorinį konteinerio paviršių.
Terminiai skaidymai
Vienas iš labiausiai paplitusių terminio skaidymo būdų yra natrio bikarbonatas, NaHCO3, gaminti CO2 ir šildomas vanduo. Daugelis kietų medžiagų, įskaitant karbonatus, linkusios suskaidyti, kad atleistų CO2 ir atitinkamą oksidą. Pavyzdžiui, kalcio karbonato skaidymas yra toks:
CaCO3 + Q => CaO + CO2
Tas pats pasakytina ir magnio, stroncio ir bario karbonatų.
Svarbu pažymėti, kad terminis skilimas skiriasi nuo degimo. Pirmajame nėra uždegimo ar šilumos išsiskyrimo, o antroje - taip; tai reiškia, kad deginimas yra egzoterminė reakcija, nors jai reikia pradinio šilumos šaltinio, kuris vyktų ar įvyktų savaime..
Amonio chloridas vandenyje
Kai mėgintuvėlyje ištirpinamas nedidelis amonio chlorido (NH4Cl) kiekis, mėgintuvėlis tampa šaltesnis nei anksčiau. Šios cheminės reakcijos metu šiluma absorbuojama iš aplinkos.
Natrio triosulfatas
Kai natrio tiosulfato kristalai (Na2S2O3.5H2O), paprastai vadinama hypo, ištirpsta vandenyje, atsiranda aušinimo efektas.
Automobilių varikliai
Benzino ar dyzelino deginimas automobilių, sunkvežimių, traktorių ar autobusų varikliuose gamina mechaninę energiją, kuri naudojama šių transporto priemonių apyvartoje..
Virimo skysčiai
Įdėjęs skystį į šilumą, jis gauna energiją ir eina į dujinę būseną.
Kiaušinio virimas
Naudojant šilumą, kiaušinių baltymai denatūruojami ir sudaro kietą struktūrą, kuri paprastai yra praryjama.
Maisto gaminimas
Apskritai, visada kepant su šiluma, kad pakeistumėte maisto savybes, vyksta endoterminės reakcijos.
Šios reakcijos sukelia maistą švelnesnę, generuoja kalio masę, atleidžia jų sudėtyje esančius komponentus.
Maisto šildymas mikrobangų krosnelėje
Mikrobangų spinduliuotėje vandens molekulės maiste sugeria energiją, pradeda vibruoti ir didina maisto temperatūrą.
Lituotas stiklas
Šilumos įsisavinimas iš stiklo daro lankstesnes jų jungtis, todėl jų forma tampa lengvesnė.
Žvakės vartojimas
Žvakių vaškas ištirpsta, nes sugeria liepsnos šilumą, keičia jo formą.
Valymas karštu vandeniu
Naudojant karštą vandenį, kad išvalytumėte tepalu dažytus daiktus, pvz., Puodus ar drabužius, tepalas tampa skystesnis ir lengviau pašalinamas.
Maisto ir kitų objektų šiluminė sterilizacija
Šildant daiktus ar maistą, jų turimi mikroorganizmai taip pat padidina jų temperatūrą.
Kai tiekiama daug šilumos, atsiranda reakcijos mikrobų ląstelių viduje. Daugelis šių reakcijų, pvz., Lūžių ar baltymų denatūracijos, baigia žudyti mikroorganizmus.
Kova su infekcijomis karščiavimu
Kai karščiavimas pasireiškia, tai yra todėl, kad organizmas gamina reikiamą šilumą, kad nužudytų bakterijas ir virusus, kurie sukelia infekcijas ir sukelia ligas..
Jei susidariusi šiluma yra didelė ir karščiavimas aukštas, taip pat paveikiamos kūno ląstelės ir yra mirties rizika.
Vandens garavimas
Kai vanduo išgaruoja ir virsta garais, tai yra dėl šilumos, kurią ji gauna iš aplinkos. Kadangi kiekviena vandens molekulė gauna šiluminę energiją, jos vibracinė energija padidėja iki taško, kur ji gali laisvai judėti, sukuriant garus.
Nuorodos
- Whitten, Davis, Peck & Stanley. (2008). Chemija (8-asis red.). Mokymosi mokymas.
- Vikipedija. (2018). Endoterminis procesas. Gauta iš: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (2018 m. Gruodžio 27 d.). Endoterminės reakcijos pavyzdžiai. Gauta iš: thinkco.com
- Khan akademija. (2019). Endoterminis vs egzoterminės reakcijos Gauta iš: khanacademy.org
- Serm Murmson. (2019). Kas vyksta molekuliniu lygiu endoterminės reakcijos metu? „Hearst Seattle Media“. Gauta iš: education.seattlepi.com
- „QuimiTube“. (2013). Reakcijos entalpijos apskaičiavimas iš formavimo entalpijų. Gauta iš: quimitube.com
- Quimicas.net (2018). Endoterminės reakcijos pavyzdžiai. Gauta iš:
quimicas.net.


