Alavo chloridas (SnCl2) Savybės, struktūra, naudojimo būdai ir pavojai
The alavo chloridas (II) arba alavo chlorido, cheminės formulės SnCl2, yra balta kristalinė kieta medžiaga, alavo ir koncentruoto druskos rūgšties tirpalo reakcijos produktas: Sn (s) + 2HCl (conc) => SnCl2(aq) + H2(g) Jo sintezės procesas (paruošimas) - tai alavo skardos gabalų pridėjimas reaguojant su rūgštimi.
Įdėjus alavo gabalus, jis atlieka dehidrataciją ir kristalizaciją, kol gaunama neorganinė druska. Šiame junginyje alavas prarado du elektronus iš savo valentinio korpuso, kad suformuotų ryšius su chloro atomais.
Tai galima geriau suprasti, jei atsižvelgiama į alavo valentinę konfigūraciją (5s25px2pir0pz0), iš kurių elektronų pora užima orbitą px yra pateiktas protonams H+, siekiant sudaryti diatominę vandenilio molekulę. Tai yra, tai yra redokso tipo reakcija.
Indeksas
- 1 Fizinės ir cheminės savybės
- 1.1 Valensijos konfigūracija
- 1.2 Reaktingumas
- 1.3 Redukcinė veikla
- 2 Cheminė struktūra
- 3 Naudojimas
- 4 Rizika
- 5 Nuorodos
Fizinės ir cheminės savybės
„SnCl“ nuorodos2 Ar jie yra joniniai arba kovalentiniai? Fizinės alavo (II) chlorido savybės atmeta pirmąjį variantą. Šio junginio lydymosi ir virimo taškai yra 247 ° C ir 623 ° C, o tai rodo silpnas tarpmolekulines sąveikas..
Jo kristalai yra balti, o tai rodo, kad matomas spektras yra nulinis.
Valensijos konfigūracija
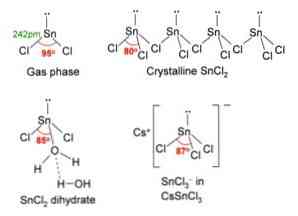
Aukščiau esančiame paveikslėlyje viršutiniame kairiajame kampe iliustruojama izoliuota SnCl molekulė2.
Molekulinė geometrija turėtų būti plokščia, nes centrinės atomo hibridizacija yra sp2 (3 orbital sp2 ir grynasis p orbitalas kovalentinių ryšių formavimui), bet laisvas elektronų pora užima tūrį ir nuspaudžia chloro atomus žemyn, suteikdama molekulei kampinę geometriją.
Dujų fazėje šis junginys yra izoliuotas, todėl jis neturi sąveikos su kitomis molekulėmis.
Kaip elektronų poros praradimas orbitoje px, alavas transformuojamas į joną Sn2+ ir jo elektroninė konfigūracija yra 5s25px0pir0pz0, su visomis savo orbitomis galima priimti nuorodas iš kitų rūšių.
Cl jonai- koordinuoti su „Sn“2+ gauti alavo chlorido. Elektroninė alavo konfigūracija šioje druskoje yra 5s25px2pir2pz0, sugebėti priimti kitą elektronų porą laisvojoje orbitoje pz.
Pavyzdžiui, galite priimti kitą Cl joną-, formuojant trigoninės plokštumos geometrijos kompleksą (piramidę su trikampiu pagrindu) ir neigiamai įkrautą [SnCl3]-.
Reaktingumas
SnCl2 turi didelį reaktyvumą ir polinkį elgtis kaip Lewis rūgštis (elektronų receptoriai), kad užbaigtų valentų oktetą.
Kaip ir priima Cl joną-, tas pats pasakytina ir apie vandenį, kuris „hidratuoja“ alavo atomą jungdamas vandens molekulę tiesiai prie alavo, o antroji vandens molekulė sujungia vandenilio jungtis su pirmuoju.
To rezultatas yra tas, kad SnCl2 ji nėra gryna, bet suderinta su vandeniu jo druskos druskoje: SnCl2· 2H2O.
SnCl2 Jis labai gerai tirpsta vandenyje ir poliariniuose tirpikliuose, nes jis yra polinis junginys. Tačiau jo tirpumas vandenyje, mažesnis nei jo masė, aktyvina hidrolizės reakciją (vandens molekulės plyšimą), kad susidarytų bazinė ir netirpi druska:
SnCl2(aq) + H2O (l) <=> Sn (OH) Cl (s) + HCl (aq)
Dviguba rodyklė rodo, kad nustatoma pusiausvyra, palankesnė kairėje (reaktorių link), jei HCl koncentracija padidėja. Dėl to „SnCl“ sprendimai2 naudojamas rūgštinis pH, kad būtų išvengta nepageidaujamo hidrolizės druskos produkto nusodinimo.
Redukcinė veikla
Reaguoja su oru esančiu deguonimi, kad susidarytų alavo (IV) chloridas arba alavo chloridas:
6 SnCl2(aq) + O2(g) + 2H2O (l) => 2SnCl4(aq) + 4Sn (OH) Cl (s)
Šioje reakcijoje alavo oksiduojasi, jungiantis su elektronegatyviniu deguonies atomu, ir padidina ryšių su chloro atomais skaičių.
Apskritai, halogenų (F, Cl, Br ir I) elektronegatyviniai atomai stabilizuoja Sn (IV) junginių ryšius ir tai paaiškina, kodėl SnCl2 tai yra reduktorius.
Kai jis oksiduojasi ir praranda visus savo valentų elektronus, „Sn“4+ jis lieka su 5s konfigūracija05px0pir0pz0, tai yra elektronų pora, esanti orbitoje 5s, kurių sunkiausia „paimti“.
Cheminė struktūra
SnCl2 pristato ororombombiško tipo kristalinę struktūrą, panašią į pjūklų eilutes, kuriose dantų galai yra chloridai..
Kiekviena eilutė yra SnCl grandinė3 suformuoti Cl tiltą su kitu Sn atomu (Cl-Sn (Cl)2-Cl- ···), kaip matyti aukščiau esančiame paveikslėlyje. Du grandinės, susietos su silpnomis Sn-Cl tipo sąveikomis, sudaro vieną sluoksnį, kuris yra ant kito sluoksnio, ir taip toliau, kol bus apibrėžta kristalinė kieta medžiaga..
Laisvos elektronų poros 5s2 iškraipo struktūrą, nes užima tūrį (elektroninio debesies tūris).
Sn gali turėti koordinavimo numerį, lygų devyniems, kuris yra tas pats, kuris turi devynis kaimynus, piešdamas trigoninę prizmę su tuo, kuris yra geometrinio figūros centre ir Cl viršūnėse, be kitų Cl, esančių kiekviename prizmės kvadratinių veidų.
Tai lengviau stebėti, jei atsižvelgiama į grandinę, kurioje Sn (tamsiai pilkos spalvos) rutuliai nukreipti į viršų, o su juo susiję trys Cl sudaro trikampį grindį, o trys viršutiniai Cl - trikampis stogas.
Naudojimas
Organinėje sintezėje jis naudojamas kaip redukuojantis agentas aromatiniams nitro junginiams (Ar-NO2 à Ar-NH2). Kadangi cheminė struktūra yra laminarinė, ji pasaulyje naudoja organinių reakcijų katalizę, be to, ji yra potencialus katalizinės paramos kandidatas..
Jo redukcinis turtas naudojamas aukso junginių buvimui nustatyti, stiklų padengimui sidabro veidrodžiais ir antioksidantu.
Be to, molekulinėje geometrijoje trigoninė piramidė (: SnX3- M+) yra naudojamas kaip Lewis bazė daugeliui junginių (pvz., Pt klasterio komplekso) sintezei3Sn8Cl20, kur elektroninė pora yra suderinta su Lewis rūgštimi).
Rizika
SnCl2 Jis gali pakenkti baltųjų kraujo kūnelių. Jis yra ėsdinantis, dirginantis, kancerogeninis ir turi didelį neigiamą poveikį jūrų ekosistemų rūšims.
Jis gali suskaidyti esant aukštai temperatūrai, atlaisvindamas kenksmingas chloro dujas. Susilietus su labai oksiduojančiomis medžiagomis, ji sukelia sprogias reakcijas.
Nuorodos
- Shiver & Atkins. (2008). Neorganinė chemija Į 14 grupės elementai (ketvirtasis leidimas, 329 psl.). Mc Graw kalnas.
- „ChemicalBook“. (2017). Gauta 2018 m. Kovo 21 d. Iš „ChemicalBook“: chemicalbook.com
- PubChem. (2018). Alavo chloridas. Gauta 2018 m. Kovo 21 d. Iš PubChem: pubchem.ncbi.nlm.nih.gov
- Vikipedija. (2017). Alavo (II) chloridas. Gauta 2018 m. Kovo 21 d. Iš Wikipedia: en.wikipedia.org
- E. G. Rochow, E. W. (1975). Vokiečių chemija: alavo ir švino (pirmasis red.). p-82,83. „Pergamom Press“.
- F. Hulliger. (1976). Sluoksnių tipo fazių struktūrinė chemija. P-120,121. D. Reidel leidybos įmonė.



