Piktrinės rūgšties struktūra, sintezė, savybės ir panaudojimas
The pikrico rūgštis yra labai nitratuotas organinis cheminis junginys, kurio pavadinimas IUPAC yra 2,4,6-trinitrofenolis. Jo molekulinė formulė yra C6H2(NE2)3OH. Tai labai rūgštis fenolis ir gali būti randamas natrio, amonio arba kalio pikrato pavidalu; tai yra jo joninė forma C6H2(NE2)3ONa.
Tai kietas, stiprus, kartaus skonio, ir iš jo kilęs iš graikų kalbos žodžio „prikos“, tai reiškia, kad jis yra kartusis. Jis randamas kaip drėgni geltoni kristalai. Jo džiovinimas ar dehidratacija yra pavojingi, nes padidina nestabilias savybes, dėl kurių jis tampa sprogus.
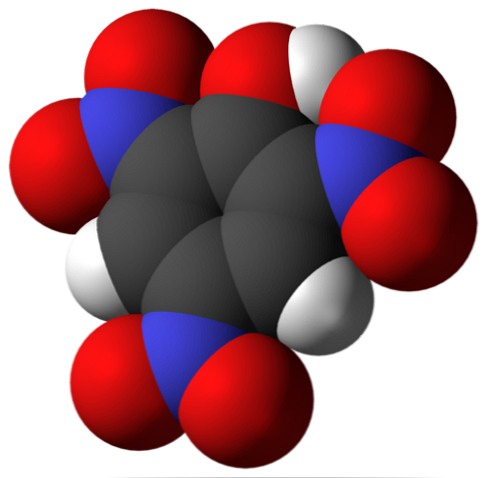
Aukščiau yra pikrinės rūgšties molekulė. Vaizde sunku atpažinti ryšius ir atomus, nes tai atitinka jo Van der Waals paviršiaus vaizdą. Molekulinė struktūra yra išsamiau aptarta kitame skyriuje.
Kai kurie tarpiniai junginiai, įvairios pikrato druskos ir pikrinės rūgšties kompleksai yra sintezuojami iš pikrico rūgšties..
Picric rūgštis naudojama kaip pagrindas geltonos spalvos nuolatinių dažų sintezei. Kai kurie patologai ir mokslininkai ją naudoja fiksuojant ar dažydami audinių sekcijas ir kitus imunohistocheminius procesus.
Tai labai naudinga ruošiant farmacijos produktus. Be to, jis naudojamas gaminant rungtynes, rungtynes ir sprogmenis. Jis taip pat naudojamas metalų graviravimui, spalvoto stiklo gamybai ir biologinių parametrų, pvz., Kreatinino, kolorimetriniam nustatymui..
Kita vertus, pikrico rūgštis dirgina, kai ji liečiasi su oda, kvėpavimo, akių ir virškinimo gleivinės. Be odos sužalojimo, jis gali stipriai paveikti inkstus, kraują ir kepenis.
Indeksas
- 1 Struktūra
- 1.1 Rūgšties fenolis
- 1.2 Kristalinė struktūra
- 2 Santrauka
- 2.1 Tiesioginė fenolio nitracija
- 3 Fizinės ir cheminės savybės
- 3.1 Molekulinė masė
- 3.2 Fizinė išvaizda
- 3.3 Kvapas
- 3.4 Skonis
- 3.5 Lydymosi temperatūra
- 3.6 Virimo temperatūra
- 3.7 Tankis
- 3.8 Tirpumas
- 3.9 Korozija
- 3.10 pKa
- 3.11 Nestabilumas
- 4 Naudojimas
- 4.1 Tyrimai
- 4.2 Organinė chemija
- 4.3 Pramonėje
- 4.4 Kariniai taikymai
- 5 Toksiškumas
- 6 Nuorodos
Struktūra

Viršutiniame vaizde išsamiau aprašomos visos pikrico rūgšties molekulės nuorodos ir struktūra. Jį sudaro fenolis su trimis nitro pakaitais.
Galima matyti, kad NO grupėse2 azoto atomas turi teigiamą dalinį įkrovimą, taigi ir jo aplinkos elektroninio tankio paklausą. Tačiau aromatinis žiedas patraukia ir elektronus, ir prieš tris NO2 jis baigia dalį savo elektroninio tankio.
Dėl šios priežasties OH grupės deguonis labiau linkęs dalytis viena laisva elektronine poromis, kad suteiktų žiedo patiriamą elektroninį trūkumą; ir taip sudarant C = O nuorodą+-H. Ši dalinė dalinė deguonies apkrova silpnina O-H ryšį ir padidina rūgštingumą; tai yra, jis bus išleistas kaip vandenilio jonas, H+.
Rūgšties fenolis
Būtent dėl šios priežasties šis junginys yra išskirtinai stipri (ir reaktyvi) rūgštis, netgi didesnė už pačią acto rūgštį. Tačiau junginys iš tikrųjų yra fenolis, kurio rūgštingumas viršija kitų fenolių rūgštingumą; kaip jau minėta, NO pakaitalams2.
Todėl, kadangi tai yra fenolis, OH grupė turi prioritetą ir nukreipia skaičiavimą į struktūrą. Trys NO2 jie yra aromatinio žiedo 2, 4 ir 6 anglies atžvilgiu OH atžvilgiu. Todėl šio junginio IUPAC nomenklatūra: 2,4,6-trinitrofenolis (TNP, jo akronimas anglų kalba).
Jei grupės nebuvo2, arba, jei žiede buvo mažesnis jų skaičius, O-H jungtis susilpnėtų, todėl junginys turėtų mažesnį rūgštingumą.
Kristalinė struktūra
Pikrico rūgšties molekulės yra išdėstytos taip, kad skatintų jų tarpusavio sąveiką; arba vandenilio tiltų susidarymui tarp OH ir NO grupių2, dipolio-dipolio jėgos arba elektrostatiniai atotrūkiai tarp trūkstamų elektronų regionų.
Gali būti tikimasi, kad grupės NEGALI2 jie atbaido vienas kitą ir būtų orientuoti į gretimus aromatinius žiedus. Be to, didėjant elektrostatinėms atramoms, žiedai negalėjo būti vieni kitiems lygūs.
Visų šių sąveikų produktas, pikrico rūgštis sugeba sudaryti trimatį tinklą, kuris apibrėžia kristalą; kurio vieneto ląstelė atitinka ortorombinio tipo kristalinę sistemą.
Sintezė
Iš pradžių ji buvo sintezuota iš natūralių junginių, pavyzdžiui, gyvūnų ragų darinių, natūralių dervų. Nuo 1841 m. Fenolis buvo naudojamas kaip pikrico rūgšties pirmtakas, sekantis keliais būdais arba naudojant įvairias chemines procedūras.
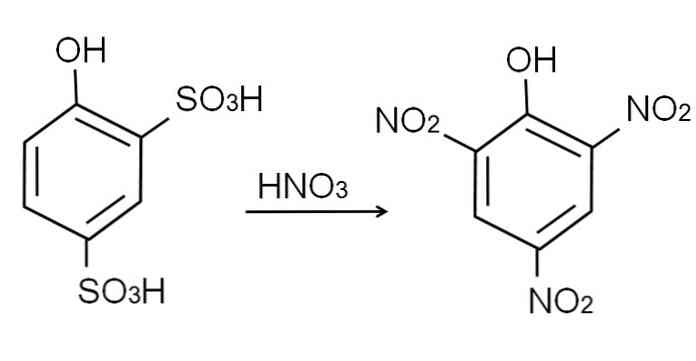
Kaip jau minėta, tai vienas iš rūgštiausių fenolių. Siekiant sintezuoti, pirmiausia reikia, kad fenolis vyktų sulfoninimo procese, o po to - nitratavimo procedūra.
Bevandenio fenolio sulfonavimas atliekamas fenolį apdorojant su riebiu sieros rūgštimi, su aromatiniais H elektrofiliniais pakaitalais sulfonatų grupėmis, SO3H, -ort padėtyje ir -OH grupėje.
Šiam produktui, 2,4-fenoldisulfono rūgštis, atliekamas nitratavimo procesas, apdorojant jį koncentruota azoto rūgštimi. Tai darydamos, dvi SO grupės3H yra pakeistas nitro grupėmis, NO2, trečdalis patenka į kitą nitro poziciją. Tai parodo ši cheminė lygtis:
Tiesioginė fenolio nitracija
Fenolio nitratavimo procesas negali būti atliekamas tiesiogiai, nes susidaro didelio molekulinio svorio dervos. Šiam sintezės metodui reikia labai atsargiai kontroliuoti temperatūrą, nes ji yra labai egzoterminė:
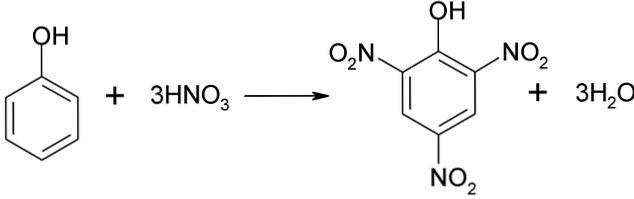
Piktrinė rūgštis gali būti gaunama atliekant tiesioginį 2,4-dinitrofenolio nitrinimo procesą su azoto rūgštimi.
Kita sintezės forma yra benzeno apdorojimas azoto rūgštimi ir gyvsidabrio nitratu.
Fizinės ir cheminės savybės
Molekulinė masė
229,104 g / mol.
Fizinė išvaizda
Drėgnų kristalų masė arba geltona suspensija.
Kvapas
Jis yra bekvapis.
Skonis
Tai labai kartūs.
Lydymosi temperatūra
122,5 ° C.
Virimo temperatūra
300 ° C Bet kai jis ištirps, jis sprogsta.
Tankis
1,77 g / ml.
Tirpumas
Tai junginys, vidutiniškai tirpus vandenyje. Taip yra todėl, kad jų OH ir NO grupės2 jie gali sąveikauti su vandens molekulėmis per vandenilio jungtis; nors aromatinis žiedas yra hidrofobinis, todėl jo tirpumas sumažėja.
Korozija
Pikio rūgštis yra korozinė medžiaga metalams, išskyrus alavo ir aliuminio.
pKa
0,38. Tai stipri organinė rūgštis.
Nestabilumas
Picric rūgščiai būdingos nestabilios savybės. Tai kelia pavojų aplinkai, yra nestabili, sprogi ir toksiška.
Kad būtų išvengta dehidratacijos, jis turi būti sandariai uždarytas, nes leidžiama išdžiūti. Turi būti labai atsargūs su bevandeniu pavidalu, nes jis yra labai jautrus trinčiai, smūgiams ir karščiui.
Pikrico rūgštis reikia laikyti vėdinamose, vėsiose vietose, toli nuo oksiduojamų medžiagų. Jis dirgina odą ir gleivines, jo negalima nuryti ir yra toksiškas organizmui.
Naudojimas
Piktrinė rūgštis plačiai naudojama tyrimams, chemijai, pramonei ir kariuomenei.
Tyrimas
Kai naudojamas kaip ląstelių ir audinių fiksatorius, jis pagerina jų spalvinimo rezultatus su rūgštiniais dažais. Tai atsitinka su trichromo dažymo metodais. Po audinio suformavimo formalinu rekomenduojama naudoti naują pikrico rūgštį.
Tokiu būdu užtikrinama intensyvi ir labai ryški audinių spalva. Gerų rezultatų negaunama su pagrindiniais dažais. Tačiau reikia imtis atsargumo priemonių, nes pikio rūgštis gali hidrolizuoti DNR, jei liko per daug laiko.
Organinė chemija
-Organinėje chemijoje jis naudojamas kaip šarminis pikratas įvairių medžiagų identifikavimui ir analizei atlikti.
-Jis naudojamas metalų analizei.
-Klinikinėse laboratorijose jis naudojamas nustatant kreatinino koncentraciją serume ir šlapime.
-Jis taip pat buvo naudojamas kai kuriuose reagentuose, kurie naudojami gliukozės kiekio analizei.
Pramonėje
-Fotografijos pramonės lygiu fotografinėje emulsijoje kaip jautrinimo priemonė buvo naudojama pikrico rūgštis. Tai buvo produktų, pvz., Pesticidų, stiprių insekticidų, kūrimo dalis.
-Picric rūgštis naudojama kitų tarpinių cheminių junginių, pvz., Chloroprinino ir pikramo rūgšties, sintezei. Iš šių junginių buvo sukurti kai kurie odos pramonei skirti vaistai ir dažikliai.
-Picric rūgštis buvo naudojama gydyti nudegimus, kaip antiseptinius ir kitus būdus, prieš įrodant jo toksiškumą..
-Svarbus komponentas dėl sprogstamumo gaminant rungtynes ir baterijas.
Kariniai taikymai
-Dėl pikino rūgšties didelio sprogumo jis buvo naudojamas karinių ginklų šaudmenų gamyklose.
-Presuota ir ištirpusi pikrico rūgštis naudojama artilerijos kevaluose, granatose, bombose ir kasyklose.
-Pikio rūgšties amonio druska buvo naudojama kaip sprogmenis, ji yra labai galinga, bet mažiau stabili nei TNT. Jau kurį laiką jis buvo naudojamas kaip raketų kuro komponentas.
Toksiškumas
Įrodyta, kad jis yra labai toksiškas žmogaus organizmui ir apskritai visoms gyvoms būtybėms.
Dėl ūmaus geriamojo toksiškumo rekomenduojama vengti jo įkvėpimo ir nurijimo. Jis taip pat sukelia mutacijas mikroorganizmuose. Pateikia toksišką poveikį laukinei gamtai, žinduoliams ir apskritai aplinkai.
Nuorodos
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organinė chemija. Aminai (10)th leidimas.). Wiley Plus.
- Carey F. (2008). Organinė chemija (Šeštasis leidimas). Mc Graw kalnas.
- Vikipedija. (2018). Piktrinė rūgštis. Gauta iš: en.wikipedia.org
- Purdue universitetas. (2004). Piktrinės rūgšties sprogimas. Gauta iš: chemed.chem.purdue.edu
- Crystallography 365 projektas. (2014 m. Vasario 10 d.). Mažiau nei minkštas geltonas - pikrico rūgšties struktūra. Gauta iš: crystallography365.wordpress.com
- PubChem. (2019). Picric Acid Gauta iš: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Picric Acid Methuen, Londonas, Jungtinė Karalystė.


