Ciklohekseno struktūra, savybės, sintezė ir panaudojimas
The cikloheksenas yra alkenas arba ciklinis olefinas, kurio molekulinė formulė yra C6H10. Jį sudaro bespalvis skystis, netirpus vandenyje ir maišomas su daugeliu organinių tirpiklių. Jis pasižymi degumu, o gamtoje jis paprastai randamas akmens anglių deguto..
Cikloheksenas sintezuojamas daliniu benzeno hidrinimu ir alkoholio cikloheksanolio dehidratavimu; tai yra rūdesnė forma. Kaip ir kiti cikloalkenai, jis reaguoja į elektrofilinį ir laisvuosius radikalus; pavyzdžiui, halogeninimo reakcija.
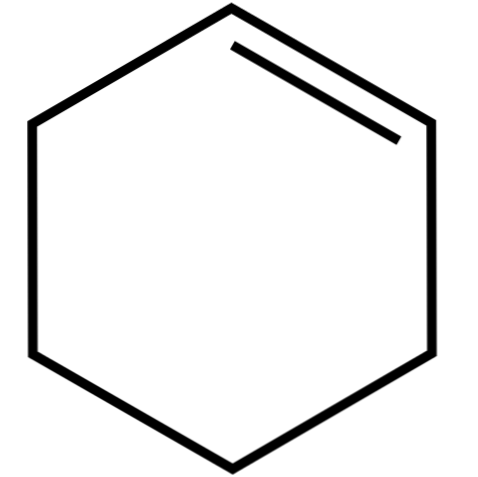
Šis ciklinis alkenas (viršutinis vaizdas) sudaro azeotropinius mišinius (kurių negalima atskirti distiliuojant) su žemesniais alkoholiais ir acto rūgštimi. Ilgai laikant jis nėra labai stabilus, nes jis suyra dėl saulės spindulių ir ultravioletinės spinduliuotės.
Cikloheksenas naudojamas kaip tirpiklis, todėl jis turi daug panaudojimo būdų, pavyzdžiui: aukšto oktaninio benzino stabilizatorius ir alyvų ekstrahavimas..
Tačiau svarbiausia yra tai, kad cikloheksenas yra tarpinė ir žaliava daugelio naudingų junginių gamybai, tarp jų: cikloheksanonas, adipo rūgštis, maleino rūgštis, cikloheksanas, butadienas, cikloheksilkarboksirūgštis ir kt..
Indeksas
- 1 Ciklohekseno struktūra
- 1.1 Intermolekulinė sąveika
- 2 Ypatybės
- 2.1 Cheminiai pavadinimai
- 2.2 Molekulinė masė
- 2.3 Fizinė išvaizda
- 2.4 Kvapas
- 2.5 Virimo temperatūra
- 2.6 Lydymosi temperatūra
- 2.7 Pliūpsnio temperatūra
- 2.8 Tirpumas vandenyje
- 2.9 Tirpumas organiniuose tirpikliuose
- 2.10 Tankis
- 2.11 Garų tankis
- 2.12 Garų slėgis
- 2.13 Savaiminis užsidegimas
- 2.14 Skilimas
- 2.15 Klampumas
- 2.16 Degimo šiluma
- 2.17 Garinimo šiluma
- 2.18 Paviršiaus įtempimas
- 2.19 Polimerizacija
- 2.20 Kvapo slenkstis
- 2.21 Lūžio rodiklis
- 2,22 pH
- 2.23 Stabilumas
- 2.24 Reakcijos
- 3 Santrauka
- 4 Naudojimas
- 5 Rizika
- 6 Nuorodos
Ciklohekseno struktūra
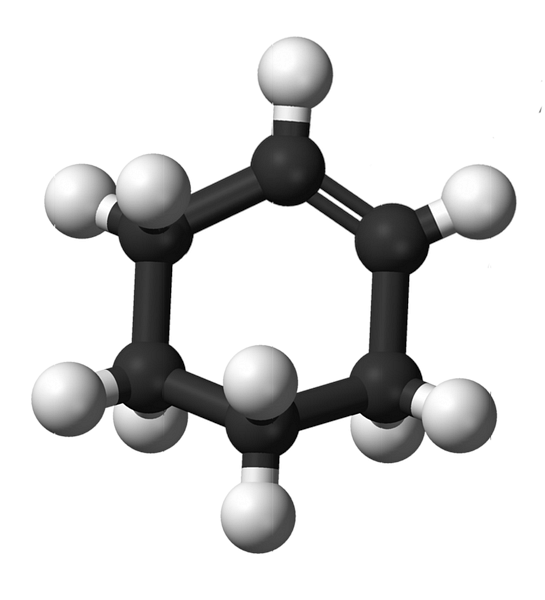
Ciklohekseno struktūra su sferų ir strypų modeliu parodyta aukščiau esančiame paveikslėlyje. Galima pastebėti šešis anglies žiedus ir dvigubą jungtį, abu junginio neprisotinimą. Šiuo požiūriu atrodo, kad žiedas yra plokščias; bet tai visai nėra.
Pradedantiesiems dvigubos jungtys turi anglies atomų2, kuri suteikia jiems trigoninės plokštumos geometriją. Todėl šie du angliavandeniai ir tie, kurie yra šalia jų, yra toje pačioje plokštumoje; o du anglies junginiai priešingame gale (dviguboje jungtyje) yra virš ir žemiau minėtos plokštumos.
Apatinis vaizdas puikiai iliustruoja ką tik paaiškinta.

Atkreipkite dėmesį, kad juoda juosta susideda iš keturių anglies: du iš dvigubos jungties ir kiti šalia jų. Atskleista perspektyva yra ta, kuri būtų gauta, jei žiūrovas savo akį įdėtų tiesiai prieš dvigubą ryšį. Tada galima matyti, kad anglis yra virš ir žemiau šios plokštumos.
Kadangi ciklohekseno molekulė nėra statinė, du anglies junginiai pasikeis: vienas bus mažesnis, o kitas pakils virš plokštumos. Taigi jūs tikitės, kad ši molekulė elgsis.
Intermolekulinė sąveika
Cikloheksenas yra angliavandenilis, todėl jo intermolekulinė sąveika grindžiama Londono dispersijos jėgomis..
Taip yra todėl, kad molekulė yra apolinė, be nuolatinio dipolio momento, ir jo molekulinė masė yra veiksnys, kuris labiausiai prisideda prie to, kad jis būtų susiliejęs skystyje..
Be to, dvigubas ryšys padidina sąveikos laipsnį, nes jis negali judėti tokiu pat lankstumu, kaip ir kitų anglies junginių, ir tai skatina kaimyninių molekulių sąveiką. Dėl šios priežasties cikloheksenas turi šiek tiek aukštesnę virimo temperatūrą (83 ° C) nei cikloheksanas (81 ° C)..
Savybės
Cheminiai pavadinimai
Cikloheksenas, tetrahidrobenzenas.
Molekulinė masė
82,146 g / mol.
Fizinė išvaizda
Bespalvis skystis.
Kvapas
Saldus kvapas.
Virimo temperatūra
83 ° C iki 760 mmHg.
Lydymosi temperatūra
-103,5 ºC.
Uždegimo taškas
-7ºC (uždara taurė).
Tirpumas vandenyje
Beveik netirpi (213 mg / l).
Tirpumas organiniuose tirpikliuose
Maišosi su etanoliu, benzenu, anglies tetrachloridu, petroleteriu ir acetonu. Tikimasi, kad ji galės ištirpinti apolinius junginius, kaip ir kai kuriuos anglies alotropus.
Tankis
0,810 g / cm3 20 ° C temperatūroje.
Garų tankis
2.8 (atsižvelgiant į orą, lygų 1).
Garų slėgis
89 mmHg esant 25ºC.
Savaiminis užsidegimas
244 ° C.
Skilimas
Skilsta, kai yra urano druskų, veikiant saulės šviesai ir ultravioletinei spinduliuotei.
Klampumas
0,625 mPascal 25 ° C temperatūroje.
Degimo šiluma
3,751,7 kJ / mol 25 ° C temperatūroje.
Garinimas
30,46 kJ / mol 25 ° C temperatūroje.
Paviršiaus įtampa
26,26 mN / m.
Polimerizacija
Jis gali polimerizuotis tam tikromis sąlygomis.
Kvapo slenkstis
0,6 mg / m3.
Lūžio rodiklis
1,4465 20 ° C temperatūroje.
pH
7-8 ° C temperatūroje.
Stabilumas
Ilgalaikio saugojimo metu cikloheksenas nėra labai stabilus. Šviesos ir oro poveikis gali sukelti peroksidų gamybą. Taip pat jis nesuderinamas su stipriais oksiduojančiais agentais.
Reakcijos
-Cikloalkenai daugiausia patiria papildomų reakcijų, tiek elektrofilinių, tiek laisvųjų radikalų.
-Reaguoja su bromu, kad susidarytų 1,2-dibromocikloheksanas.
-Greitai oksiduojasi esant kalio permanganatui (KMnO4).
-Jis gali gaminti epoksidą (ciklohekseno oksidą), esant peroksibenzenkarboksirūgščiai.
Sintezė
Cikloheksenas gaunamas naudojant cikloheksanolio rūgštinę katalizę:
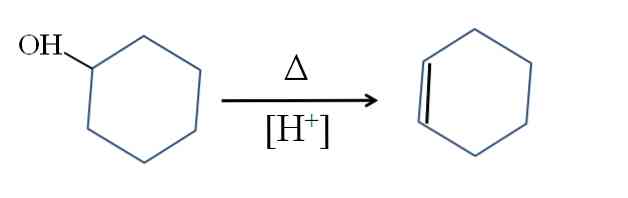
Simbolis A reiškia šilumą, reikalingą OH grupės kaip vandens molekulės išeikvojimui rūgštinėje terpėje (-OH2+).
Cikloheksenas taip pat gaminamas dalinai hidrinant benzeną; tai reiškia, kad dvi jos dvigubos jungtys prideda vandenilio molekulę:
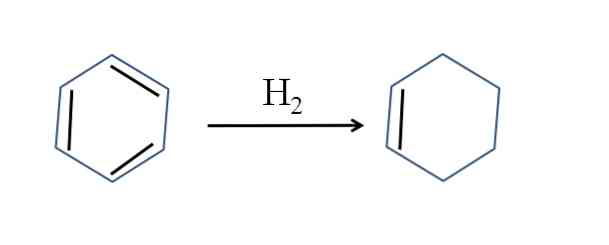
Nors reakcija atrodo paprasta, reikia didelių H slėgių2 ir katalizatoriai.
Naudojimas
-Jis yra naudingas kaip organinis tirpiklis. Be to, tai yra žaliava adipo rūgšties, adipo aldehido, maleino rūgšties, cikloheksano ir cikloheksilkarboksirūgšties gamybai..
-Jis naudojamas cikloheksano chlorido, junginio, naudojamo kaip tarpininkas farmacijos produktų ir gumos priedų gamyboje, gamyboje..
-Cikloheksenas taip pat naudojamas cikloheksanono, žaliavų, skirtų vaistų, pesticidų, kvepalų ir dažiklių gamybai, sintezei..
-Cikloheksenas dalyvauja aminocikloheksanolio, junginio, kuris naudojamas kaip paviršinio aktyvumo medžiaga ir emulsiklis, sintezėje..
-Be to, butadieno laboratorijoje galima naudoti ciklohekseną. Pastarasis junginys naudojamas gaminant sintetinį kaučiuką, gaminant automobilių padangas, taip pat naudojamas akrilo plastikai gaminti..
-Cikloheksenas yra žaliava lizino, fenolio, policikloolefino dervos ir gumos priedų sintezei..
-Jis naudojamas kaip aukšto oktaninio benzino stabilizatorius.
-Dalyvauja vandeniui atsparių dangų, įtrūkių atsparių plėvelių ir rišamųjų medžiagų rišamųjų medžiagų sintezėje.
Rizika
Cikloheksenas nėra labai toksiškas junginys, tačiau jis gali sukelti odos ir akių paraudimą. Jo įkvėpimas gali sukelti kosulį ir mieguistumą. Be to, jo nurijimas gali sukelti mieguistumą, kvėpavimo sunkumą ir pykinimą.
Cikloheksenas yra blogai absorbuojamas virškinamajame trakte, todėl dėl prarijus nepageidaujami sunkūs sisteminiai poveikiai. Didžiausia komplikacija yra kvėpavimo takų įkvėpimas, kuris gali sukelti cheminę pneumoniją.
Nuorodos
- Joseph F. Chiang ir Simon Harvey Bauer. (1968). Ciklohekseno molekulinė struktūra. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). Cikloheksenas: pavojai, sintezė ir struktūra. Tyrimas. Gauta iš: study.com
- Morrison, R. T. ir Boyd, R. N. (1987). Organinė chemija (5ta Leidimas.). Redakcija Addison-Wesley Iberoamericana.
- PubChem. (2019). Cikloheksenas. Gauta iš: pubchem.ncbi.nlm.nih.gov
- Cheminė knyga. (2019). Cikloheksenas. Gauta iš: chemicalbook.com
- Toksikologijos duomenų tinklas. (2017). Cikloheksenas. „Toxnet“ Gauta iš: toxnet.nlm.nih.gov
- Chemoksi. (s.f.). Ciklohekseno struktūrinė formulė yra. Gauta iš: chemoxy.com


