Berilio oksido (BeO) struktūra, savybės ir panaudojimas
The berilio oksidas (BeO) yra keraminė medžiaga, kuri, be savo didelio stiprumo ir elektrinės varžos, turi didelį šilumos laidumo pajėgumą, dėl kurio ji tampa branduolinių reaktorių dalimi, viršijant net šio paskutinio turto metalus..
Be naudingumo kaip sintetinės medžiagos, ji taip pat gali būti randama gamtoje, nors ir retai. Jos valdymas turi būti atliekamas atsargiai, nes jis gali labai pakenkti žmonių sveikatai.
Šiuolaikiniame pasaulyje pastebėta, kaip su technologijų kompanijomis susiję mokslininkai atliko tyrimus, kad sukurtų pažangias medžiagas gana specializuotoms programoms, pvz., Toms, kurios atitinka puslaidininkių medžiagas ir kosmoso pramonę..
To pasekoje buvo atrasta medžiagų, kurios dėl savo itin naudingų savybių ir didelio patvarumo suteikė mums galimybę iš anksto judėti į priekį, leidžiančią mūsų technologiją pasiekti aukštesniu lygiu..
Indeksas
- 1 Cheminė struktūra
- 2 Ypatybės
- 2.1 Elektros laidumas
- 2.2 Šilumos laidumas
- 2.3 Optinės savybės
- 2.4 Sveikatos rizika
- 3 Naudojimas
- 3.1 Elektroninės programos
- 3.2 Branduolinės programos
- 3.3 Kitos programos
- 4 Nuorodos
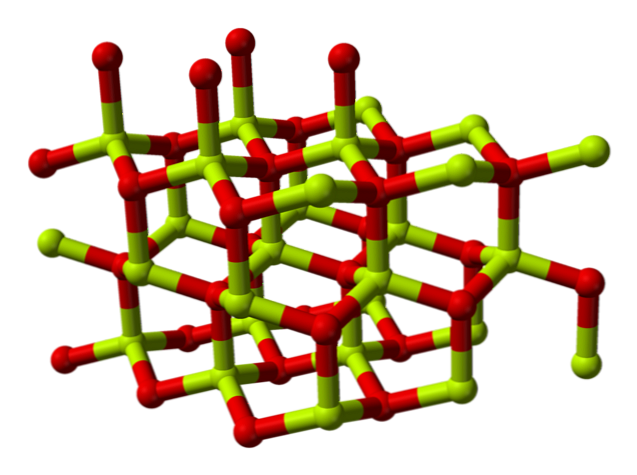
Cheminė struktūra
Berilio oksido molekulė (taip pat vadinama „Berilia“) Jį sudaro berilio atomas ir deguonies atomas, kurie abu yra koordinuojami tetraedrine orientacija, ir yra kristalizuoti šešiakampėse kristalinėse struktūrose, vadinamose wurtzites.
Šie kristalai turi tetraedrinius centrus, kuriuos užima „Be“2+ ir O2-. Aukštoje temperatūroje berilio oksido struktūra tampa tetragonal.
Berilio oksido gavimas pasiekiamas trimis būdais: berilio karbonato kalcinavimas, berilio hidroksido dehidratacija arba berilio metalo uždegimas. Aukštoje temperatūroje susidaręs berilio oksidas yra inertinis, tačiau gali būti ištirpintas keliais junginiais.
BeCO3 + Šiluma → BeO + CO2 (Apskaičiavimas)
Be (OH)2 → BeO + H2O (dehidratacija)
2 Be + O2 → 2 „BeO“ (uždegimas)
Galiausiai, berilio oksidas gali būti garinamas, ir šiuo atveju jis bus pateiktas diatominių molekulių pavidalu..
Savybės
Berilio oksidas gamtoje pasireiškia kaip bromelitas, baltas mineralas, randamas kai kuriuose kompleksiniuose mangano geležies nuosėdose, bet dažniau randamas sintetinėje formoje: balta amorfinė kieta medžiaga, kuri gaminama miltelių pavidalu..
Be to, gamybos metu užsikimšusios priemaišos oksido mėginiui suteiks įvairių spalvų.
Jo lydymosi temperatūra yra 2507 ° C, jo virimo temperatūra yra 3900 ° C ir jos tankis yra 3,01 g / cm.3.
Taip pat jos cheminis stabilumas yra labai aukštas, reaguoja tik su vandens garais, esant beveik 1000 ° C temperatūrai, ir gali atsispirti anglies redukcijos procesams ir išlydytų metalų atakoms aukštoje temperatūroje.
Be to, jo mechaninis stiprumas yra tinkamas ir gali būti patobulintas projektuojant ir gaminant, tinkamus komerciniam naudojimui.
Elektros laidumas
Berilio oksidas yra labai stabili keraminė medžiaga, todėl turi labai didelę elektrinę varžą, todėl jis yra vienas iš geriausių elektros izoliacinių medžiagų, kartu su aliuminio oksidu..
Dėl šios priežasties ši medžiaga dažniausiai naudojama specializuotoms aukšto dažnio elektros įrangai.
Šilumos laidumas
Berilio oksidas turi didelį pranašumą šilumos laidumo požiūriu: jis yra antras geriausias nemetalinių medžiagų šilumos laidumas, viršijantis tik deimantą, o medžiaga yra daug brangesnė ir retesnė.
Kalbant apie metalus, tik varis ir sidabras perduoda šilumą geresniu laidumu nei berilio oksidas, todėl tai labai pageidautina medžiaga.
Dėl savo puikių šilumos laidumo savybių ši medžiaga yra susijusi su ugniai atsparių medžiagų gamyba.
Optinės savybės
Dėl savo kristalinių savybių, berilio oksidas naudojamas skaidriai medžiagai įdėti į ultravioletines spindulius tam tikruose plokščiuosiuose ekranuose ir fotovoltiniuose elementuose..
Taip pat gali būti gaminami labai aukštos kokybės kristalai, todėl šios savybės pagerėja pagal naudojamą gamybos procesą.
Pavojus sveikatai
Berilio oksidas yra junginys, kuris turi būti tvarkomas labai atsargiai, nes jis pirmiausia turi kancerogeninių savybių, kurios buvo susijusios su nuolatiniu šios medžiagos miltelių ar garų įkvėpimu..
Mažos dalelės šiose oksido fazėse prilipusios prie plaučių ir gali sukelti navikų susidarymą arba ligą, vadinamą berilio..
Beriliozė yra liga, kurios mirtingumas vidutiniškai sukelia neveiksmingą kvėpavimą, kosulį, svorio kritimą ir karščiavimą bei granulomų susidarymą plaučiuose ar kituose paveiktuose organuose..
Taip pat kyla pavojus dėl tiesioginio sąlyčio su berilio oksidu su oda, nes jis yra ėsdinantis ir dirginantis, taip pat gali pakenkti odos paviršiui ir gleivinėms. Dirbant su šia medžiaga, ypač miltelių pavidalu, reikia apsaugoti kvėpavimo takus ir rankas.
Naudojimas
Berilio oksido panaudojimas daugiausia skirstomas į tris: elektronines, branduolines ir kitas programas.
Elektroninės programos
Gebėjimas perkelti šilumą į aukštą lygį ir jo gerą elektrinę varžą padarė, kad berilio oksidas įgyja didelį naudingumą kaip šilumnešis.
Jo naudojimas įrodytas grandinėse, esančiose didelės talpos kompiuteriuose, be įrangos, valdančios didelės elektros srovės.
Berilio oksidas yra skaidrus rentgeno spinduliams ir mikrobangų krosnelėms, todėl jis naudojamas languose nuo šių spinduliuotės tipų, taip pat antenos, ryšių sistemos ir mikrobangų krosnelės..
Branduolinės programos
Dėl jo gebėjimo vidutiniškai neutralizuoti neutronus ir išlaikyti jo struktūrą, berylio oksidas dalyvauja branduolinių reaktorių statyboje ir gali būti naudojamas ir aukštos temperatūros reaktoriuose, kuriuos atvėsina dujos.
Kitos programos
Mažas berilio oksido tankis sukėlė susidomėjimą kosmoso ir karinių technologijų pramone, nes jis gali būti mažo svorio pasirinkimas raketų varikliams ir nešiojamoms liemenėms..
Galiausiai ji neseniai buvo naudojama kaip ugniai atspari medžiaga metalų sintezėje metalurgijos pramonėje.
Nuorodos
- PubChem. (s.f.). Berilio oksidas. Gauta iš pubchem.ncbi.nlm.nih.gov
- Skaitykite. (s.f.). Berilija / berilio oksidas (BeO). Atkurta iš „reade.com“
- Research, C. (s.f.). Berilio oksidas - berilija. Gauta iš azom.com
- Services, N. J. (s.f.). Berilio oksidas. Gauta iš nj.gov
- Vikipedija. (s.f.). Berilio oksidas. Gauta iš en.wikipedia.org


