Anglies tetrachlorido (CCl4) struktūra, savybės, panaudojimas, toksiškumas
The tetrachloridas Jis yra bespalvis skystis, šiek tiek saldus kvapas, panašus į eterio ir chloroformo kvapą. Jo cheminė formulė yra CCl4, ir jis yra kovalentinis ir lakus junginys, kurio garai yra didesni nei oras; Tai nėra palanki elektros energijai ir nėra degi.
Jis randamas atmosferoje, upių vandenyje, jūroje ir jūros paviršiaus nuosėdose. Manoma, kad raudonųjų dumblių anglies tetrachloridas yra sintezuojamas to paties organizmo.
Atmosferoje jis gaminamas chloro ir metano reakcija. Pramoniniu būdu pagamintas anglies tetrachloridas patenka į vandenyną, daugiausia per jūros ir oro sąsają. Apskaičiuota, kad jos atmosferos srautas => vandenynas yra 1,4 x 1010 g / per metus, ty 30% viso atmosferos anglies tetrachlorido.
Indeksas
- 1 Pagrindinės charakteristikos
- 2 Struktūra
- 3 Fizinės ir cheminės savybės
- 4 Naudojimas
- 4.1 Cheminė gamyba
- 4.2 Šaldymo medžiagų gamyba
- 4.3 Gaisro slopinimas
- 4.4 Valymas
- 4.5 Cheminė analizė
- 4.6 Infraraudonųjų spindulių spektroskopija ir branduolinis magnetinis rezonansas
- 4.7 Tirpiklis
- 4.8 Kiti naudojimo būdai
- 5 Toksiškumas
- 5.1 Hepatotoksiniai mechanizmai
- 5.2 Toksiškas poveikis inkstų sistemai ir centrinei nervų sistemai
- 5.3 Poveikio žmogui poveikis
- 5.4 Toksiška sąveika
- 6 Intermolekulinė sąveika
- 7 Nuorodos
Pagrindinės charakteristikos
Anglies tetrachloridas gaminamas pramoniniu būdu terminiu metano chlorinimu, o metanas reaguoja su chloro dujomis 400–430 ° C temperatūroje. Reakcijos metu susidaro neapdorotas produktas su šalutiniu druskos rūgšties produktu.
Jis taip pat gaminamas pramoniniu būdu naudojant anglies disulfido metodą. Chloras ir anglies disulfidas reaguoja 90 ° C iki 100 ° C temperatūroje, naudojant katalizatorių geležį. Tada žaliavinis produktas yra frakcionuojamas, neutralizuojamas ir distiliuojamas.
CCl4 buvo daug kartų panaudota, be kita ko: riebalų, aliejų, lakų ir kt. tirpiklis; drabužių sausas valymas; pesticidų, žemės ūkio ir fungicidinio fumigavimo ir nailono gamybos. Tačiau, nepaisant jo didelio naudingumo, dėl didelio toksiškumo jis buvo iš dalies pašalintas.
Žmonėms jis sukelia toksišką poveikį odai, akims ir kvėpavimo takams. Tačiau jo žalingiausias poveikis pasireiškia centrinės nervų sistemos, kepenų ir inkstų funkcionavime. Inkstų pažeidimas yra pagrindinė mirties priežastis, susijusi su toksišku anglies tetrachlorido poveikiu.
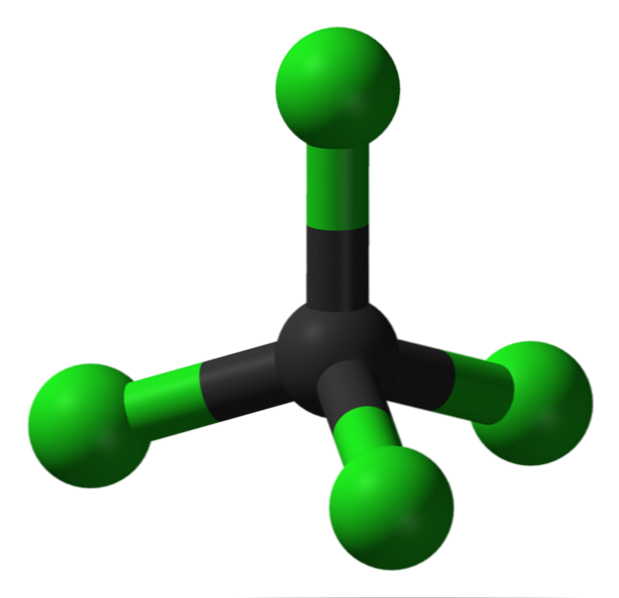
Struktūra
Paveikslėlyje galite matyti tetrachlorido, kuris yra tetrahedras, geometrija. Atkreipkite dėmesį, kad Cl atomai (žalieji rutuliai) yra orientuoti į anglies aplinką (juodą sferą), piešiant tetredroną.
Taip pat verta paminėti, kad, kadangi visos tetraedro viršūnės yra identiškos, struktūra yra simetriška; tai yra, nesvarbu, kaip pasukama CCl molekulė4, Jis visada bus tas pats. Tada, nuo žalios Tetretrono CCl4 yra simetriškas, todėl nėra nuolatinio dipolio momento.
Kodėl? Kadangi nors C-Cl ryšys yra polinis dėl didesnio Cl elektroninio elektroniškumo C atžvilgiu, šios akimirkos atšaukiamos vektoriškai. Todėl tai yra apolinis chlorintas organinis junginys.
Anglis yra visiškai chloruotas CCl4, kas yra lygi didelei oksidacijai (anglis gali sudaryti daugiausia keturias jungtis su chloru). Šis tirpiklis nėra linkęs prarasti elektronų, tai yra aprotinis (jis neturi vandenilio), jis yra transporto priemonė ir nedidelis chloro laikymas..
Fizinės ir cheminės savybės
Formulė
CCl4
Molekulinė masė
153,81 g / mol.
Fizinė išvaizda
Tai bespalvis skystis. Jis kristalizuojasi monoklininių kristalų pavidalu.
Kvapas
Pateikiamas būdingas kvapas, esantis kituose chlorintuose tirpikliuose. Kvapas yra aromatinis ir šiek tiek saldus, panašus į tetrachloretileno ir chloroformo kvapą.
Virimo temperatūra
170,1 ° F (76,8 ° C) iki 760 mmHg.
Lydymosi temperatūra
-9ºF (-23ºC).
Tirpumas vandenyje
Jis blogai tirpsta vandenyje: 1,16 mg / ml 25 ° C temperatūroje ir 0,8 mg / ml 20 ° C temperatūroje. Kodėl? Kadangi vanduo, labai poliarinė molekulė, „nejaučia“ anglies tetrachlorido afiniteto, kuris yra apolinis.
Tirpumas organiniuose tirpikliuose
Dėl molekulinės struktūros simetrijos anglies tetrachloridas yra ne polinis junginys. Todėl jis yra maišomas su alkoholiu, benzenu, chloroformu, eteriu, anglies disulfidu, petroleteriu ir benzinu. Taip pat jis tirpsta etanolyje ir acetone.
Tankis
Skystoje būsenoje: 1,59 g / ml esant 68 ° F ir 1,594 g / ml 20 ° C temperatūroje.
Kietoje būsenoje: 1,831 g / ml esant -186 ° C ir 1,809 g / ml -80 ° C temperatūroje.
Stabilumas
Paprastai inertiška.
Ėsdinantis poveikis
Reaguoja į kai kurias plastiko, kaučiuko ir dangų formas.
Uždegimo taškas
Manoma, kad jis nėra labai degus, nurodant, kad užsidegimo taškas yra mažesnis nei 982 ° C.
Automatinis uždegimas
982 ° C (1800 ° F; 1255 K).
Garų tankis
5.32, palyginti su oru, laikoma lygiaverte 1.
Garų slėgis
91 mmHg esant 68 ° F; 113 mmHg esant 77 ° F ir 115 mmHg 25 ° C temperatūroje.
Skilimas
Gaisro metu susidaro chloridas ir fosgenas, stipriai toksiškas junginys. Panašiai tokiomis pačiomis sąlygomis jis suskaido į vandenilio chloridą ir anglies monoksidą. Esant vandeniui esant aukštai temperatūrai, jis gali sukelti druskos rūgštį.
Klampumas
2,03 x 10-3 Pa · s
Kvapo slenkstis
21,4 ppm.
Lūžio rodiklis (ηD)
1,4607.
Naudojimas
Cheminė gamyba
-Jis veikia kaip chloravimo agentas ir (arba) tirpiklis, gaminant organinį chlorą. Be to, ji įsikiša kaip monomeras gaminant nailoną.
-Veikia kaip tirpiklis gaminant gumos cementą, muilą ir insekticidą.
-Jis naudojamas gaminant chlorofluorangliavandenilį.
-Neturint C-H ryšių anglies tetrachloridas neturi laisvųjų radikalų reakcijų, todėl jis yra naudingas tirpiklis halogeninti, arba elementiniu halogenu, arba halogeninimo reagentu, tokiu kaip N-bromosukcinimidas..
Šaldymo medžiagų gamyba
Jis buvo naudojamas chlorfluorangliavandenilių, šaltnešio R-11 ir trichlorfluormetano, šaltnešio R-12 gamybai. Šios šaldymo medžiagos sunaikina ozono sluoksnį, todėl rekomendavo nutraukti jų naudojimą pagal Monrealio protokolo rekomendacijas..
Gaisro slopinimas
20-ojo amžiaus pradžioje anglies tetrachloridas buvo pradėtas naudoti kaip gesintuvas, pagrįstas junginio savybėmis: jis yra lakus; jo garai yra sunkesni už orą; Tai nėra elektros laidininkas ir jis nėra labai degus.
Šildant anglies tetrachloridas tampa sunkiu garu, kuris padengia degimo produktus, išskiria juos nuo oro deguonies ir sukelia ugnį. Jis tinka kovoti su naftos gaisrais ir prietaisais.
Tačiau esant aukštesnei nei 500 ° C temperatūrai, tetrachloridas gali reaguoti su vandeniu, sukeldamas fosgeną, toksišką junginį, todėl naudojimo metu reikia atkreipti dėmesį į vėdinimą. Be to, jis gali sprogiai reaguoti su metaliniu natrio druska, vengdamas jo panaudojimo gaisro metu, esant tokiam metalui.
Valymas
Anglies tetrachloridas buvo naudojamas drabužių ir kitų medžiagų, skirtų naudoti namuose, sauso valymo metu. Be to, jis naudojamas kaip pramoninis metalų riebalų šalinimo priemonė, puikiai tinka tirpinti riebalus ir aliejų.
Cheminė analizė
Jis naudojamas boro, bromido, chlorido, molibdeno, volframo, vanadžio, fosforo ir sidabro aptikimui..
Infraraudonųjų spindulių spektroskopija ir branduolinis magnetinis rezonansas
-Jis naudojamas kaip tirpiklis infraraudonųjų spindulių spektroskopijoje, nes anglies tetrachloridas neturi didelės absorbcijos juostose> 1600 cm.-1.
-Jis buvo naudojamas kaip tirpiklis branduoliniame magnetiniame rezonanse, nes jis netrukdė technikai, nes neturėjo vandenilio (tai yra aprotinis). Tačiau dėl jo toksiškumo ir dėl to, kad tirpiklio galia yra maža, anglies tetrachloridas buvo pakeistas deuteruotais tirpikliais..
Tirpiklis
Ne poliarinio junginio savybė leidžia naudoti anglies tetrachloridą kaip tirpiklį aliejui, riebalams, lakams, lakams, gumos vaškams ir dervoms. Jis taip pat gali ištirpinti jodą.
Kiti naudojimo būdai
-Tai svarbus komponentas lavos lempose, nes dėl savo tankio anglies tetrachloridas padidina vaško svorį.
-Naudojamas antspaudų kolekcionieriams, nes jis atskleidžia antspaudų vandenženklius nesukeliant žalos.
-Jis buvo naudojamas kaip pesticidas, fungicidas ir grūdų purškimas, siekiant pašalinti vabzdžius.
-Metalo pjovimo procese jis naudojamas kaip tepalas.
-Jis buvo naudojamas veterinarijoje kaip anthelmintikas gydant fasciolasis, kurį sukėlė Fasciola hepatica avis..
Toksiškumas
-Anglies tetrachloridas gali būti absorbuojamas per kvėpavimo takus, virškinimo, akių ir odos takus. Nurijimas ir įkvėpimas yra labai pavojingi, nes jie gali sukelti ilgalaikius sunkius smegenų, kepenų ir inkstų pažeidimus.
-Kontaktas su oda sukelia dirginimą ir ilgainiui gali sukelti dermatitą. Susilietimas su akimis sukelia dirginimą.
Hepatotoksiniai mechanizmai
Pagrindiniai kepenų pažeidimą sukeliantys mechanizmai yra oksidacinis stresas ir kalcio homeostazės pakeitimas..
Oksidacinis stresas yra pusiausvyra tarp reaktyviųjų deguonies rūšių gamybos ir kūno sugebėjimo generuoti redukuojančią aplinką savo ląstelėse, kontroliuojančiose oksidacinius procesus..
Normalus redokso būklės disbalansas gali sukelti toksinį poveikį gaminant peroksidus ir laisvuosius radikalus, kurie kenkia visiems ląstelių komponentams.
Anglies tetrachloridas metabolizuojamas gaminant laisvuosius radikalus: Cl3C. (radikalinis trichlormetilas) ir Cl3COO. (radikalinis trichlormetilperoksidas). Šie laisvieji radikalai sukelia lipoperoksidaciją, kuri sukelia kepenų ir plaučių pažeidimus.
Laisvieji radikalai taip pat sukelia kepenų ląstelių plazmos membranos plyšimą. Dėl to padidėja kalcio citozolinė koncentracija ir sumažėja kalcio sekvestracijos mechanizmas.
Intraląstelinis kalcio kiekio padidėjimas aktyvuoja fosfolipazės A fermentą2 kuris veikia membranos fosfolipidus, dar labiau apsunkindamas jo poveikį. Be to, atsiranda neutrofilų ir kepenų ląstelių pažeidimų infiltracija. Yra sumažėjusi ATP ir glutationo koncentracija, kuri sukelia fermentinę inaktyvaciją ir ląstelių mirtį.
Toksiškas poveikis inkstų sistemai ir centrinei nervų sistemai
Anglies tetrachlorido toksinis poveikis pasireiškia inkstų sistemoje su sumažėjusiu šlapimo ir kūno vandens kaupimu. Ypač plaučiuose ir metabolinių atliekų koncentracijos kraujyje padidėjimas. Tai gali sukelti mirtį.
Centrinės nervų sistemos lygmenyje dalyvauja nervų impulsų axoninis laidumas.
Žmogaus poveikio poveikis
Trumpas laikotarpis
Akių dirginimas; poveikis kepenims, inkstams ir centrinei nervų sistemai gali sukelti sąmonės netekimą.
Ilga trukmė
Dermatitas ir galimas kancerogeninis poveikis.
Toksiška sąveika
Yra ryšys tarp daugelio intoksikacijos atvejų su anglies tetrachloridu ir alkoholio vartojimu. Pernelyg didelis alkoholio vartojimas sukelia kepenų pažeidimą, kai kuriais atvejais sukelia kepenų cirozę.
Pastebėta, kad anglies tetrachlorido toksiškumas didėja barbitūratais, nes jie turi tokį patį toksišką poveikį.
Pavyzdžiui, inkstų lygiu barbitūratai mažina šlapimo išsiskyrimą, šis barbitūratų poveikis panašus į toksišką anglies tetrachlorido poveikį inkstų funkcijai..
Intermolekulinė sąveika
CCl4 Jis gali būti laikomas žaliuoju tetraedru. Kaip ji sąveikauja su kitais?
Būdama apoline molekule, be nuolatinio dipolio momento, ji negali sąveikauti su dipolio-dipolio jėgomis. Norėdami laikyti savo molekules kartu skystyje, chloro atomai (tetrahedra viršūnės) tam tikru būdu turi sąveikauti tarpusavyje; Londono dispersijos pajėgos yra sėkmingos.
Elektroniniai „Cl“ atomų debesys judina ir trumpoms akimirkoms generuoja turtingus ir neturtingus elektronų plotus; tai yra, jie generuoja momentinius dipoles.
Didelis elektronų δ plotas sukelia kaimyninės molekulės Cl atomą poliarizuoti: Clδ-δ+Taigi, du Cl atomai gali būti laikomi kartu ribotą laiką.
Tačiau turėdami milijonus CCl molekulių4, sąveika tampa pakankamai veiksminga, kad normaliomis sąlygomis susidarytų skystis.
Be to, keturi K, kurie kovalentiškai susieti su kiekvienu C, žymiai padidina šių sąveikų skaičių; tiek daug, kad virinama 76,8 ° C temperatūroje, aukštoje virimo temperatūroje.
CCl virimo temperatūra4 ji negali būti didesnė, nes tetrahedra yra palyginti maža, palyginti su kitais apoliniais junginiais (pvz., ksilenu, kuris verda 144 ° C temperatūroje)..
Nuorodos
- Hardinger A. Steven. (2017). Iliustruotas organinės chemijos žodynas: anglies tetrachloridas. Gauta iš: chem.ucla.edu
- Visi Siyavula. (s.f.). Intermolekulinės ir interatominės jėgos. Gauta iš: siyavula.com
- Carey F. A. (2006). Organinė chemija (Šeštasis leidimas). Mc Graw kalnas.
- Vikipedija. (2018). Anglies tetrachloridas. Gauta iš: en.wikipedia.org
- PubChem. (2018). Anglies tetrachloridas. Gauta iš: pubchem.ncbi.nlm.nih.gov
- Cheminė knyga. (2017). Anglies tetrachloridas. Gauta iš: chemicalbook.com


