Elektronų jūros teorija Pagrindai, savybės ir trūkumai
The elektronų elektronų teorija Tai hipotezė, kuri paaiškina išskirtinį cheminį reiškinį, atsirandantį metaliniuose ryšiuose tarp elementų, turinčių mažą elektronegatyvumą. Tai apie elektronų pasidalijimą tarp įvairių atomų, susietų su metalinėmis obligacijomis.
Elektroninis tankis tarp šių ryšių yra toks, kad elektronai yra perkeliami ir sudaro „jūrą“, kur jie laisvai juda. Jis taip pat gali būti išreikštas kvantine mechanika: kai kurie elektronai (paprastai nuo vieno iki septynių per atomą) yra išdėstyti orbituose su keliais centrais, kurie ištempti per metalinį paviršių.
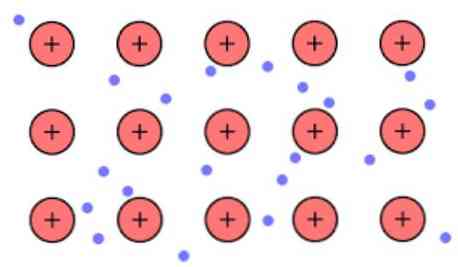
Be to, elektronai išlaiko tam tikrą vietą metale, nors elektroninio debesies pasiskirstymo tikimybė yra didesnė dėl kai kurių specifinių atomų. Taip yra dėl to, kad taikant tam tikrą srovę jie parodo savo laidumą tam tikra kryptimi.
Indeksas
- 1 Elektronų jūros teorijos pagrindai
- 2 Ypatybės
- 2.1. Sluoksnių forma
- 2.2 Elektronų jūros metodas metaliniuose kristaluose
- 3 Teorijos trūkumai
- 4 Nuorodos
Elektronų jūros teorijos pagrindai
Metaliniai elementai turi didelę tendenciją paaukoti elektronus iš savo paskutinio energijos lygio (valentinio sluoksnio), nes jų jonizacijos energija yra tokia maža, palyginti su kitais elementais.
Žinodami tai, kiekvienas metalinis elementas gali būti laikomas katijonu, susietu su paskutinio jo energijos lygio elektronu, kuris būtų labiau linkęs paaukoti.
Kaip ir metalo, turite daug atomų, kurie yra tarpusavyje susiję, galite daryti prielaidą, kad šis metalas sudaro metalinių katijonų grupę, kuri yra panardinta į tam tikrą valentinių elektronų jūrą, turinčią didelį išjungimą.
Atsižvelgiant į tai, kad tarp katijono (teigiamo krūvio) ir elektrono (neigiamo krūvio) egzistuojančių elektrostatinių traukos jėgų yra stipriai susieti metaliniai atomai, jis įsivaizduoja valentinių elektronų, kurie elgiasi kaip elektrostatiniai klijai, delokalizaciją. prie metalinių katijonų.
Tokiu būdu galima daryti išvadą, kad kuo didesnis metalo valentiniame sluoksnyje esančių elektronų skaičius, toks elektrostatinis klijai bus stipresni.
Savybės
Elektronų jūros teorija siūlo paprastą metalo rūšių, pvz., Atsparumo, laidumo, lankstumo ir tempiamumo, charakteristikų paaiškinimą, kurie įvairiose metalo dalyse skiriasi.
Nustatyta, kad metalų atsparumas atsirado dėl didelio jų elektronų perkėlimo, o tai sukuria labai didelę sanglaudos jėgą tarp jos sudarančių atomų..
Tokiu būdu, lankstumas yra žinomas kaip tam tikrų medžiagų gebėjimas leisti jų struktūrą deformuotis, nesuteikiant pakankamai pertraukos, kai jie patenka į tam tikras jėgas.
Offshoring sluoksnių pavidalu
Metalo lankstumą ir tempiamumą lemia tai, kad valentiniai elektronai yra perkeliami visomis kryptimis sluoksnių pavidalu, o tai verčia juos judėti vienas nuo kito pagal išorinę jėgą, vengiant metalo struktūros, bet leidžiant jo deformacijai.
Panašiai delokalizuotų elektronų judėjimo laisvė leidžia elektros srovės srautą, todėl metalai turi labai gerą elektros laidumą.
Be to, šis laisvo elektronų judėjimo reiškinys leidžia kinetinę energiją perduoti tarp skirtingų metalų regionų, kurie skatina šilumos perdavimą ir sukelia metalų aukštą šilumos laidumą.
Elektronų jūros teorija metaliniuose kristaluose
Kristalai yra kietos medžiagos, turinčios fizines ir chemines savybes, pvz., Tankį, lydymosi temperatūrą ir kietumą, kurios nustatomos pagal jėgas, kurios sudaro daleles, padedančias joms išlikti kartu.
Tam tikra prasme manoma, kad metalinio tipo kristalai turi paprasčiausias struktūras, nes kiekvienas „kristalų tinklo“ taškas buvo užimtas paties metalo atomo..
Ta pačia prasme buvo nustatyta, kad metalinių kristalų struktūra paprastai yra kubinė ir orientuota į veidus arba kūną..
Tačiau šios rūšys taip pat gali būti šešiakampės ir turi gana kompaktišką pakuotę, kuri suteikia jiems tokį didžiulį tankį, kuris yra būdingas..
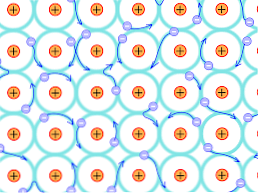
Dėl šios struktūrinės priežasties metaliniuose kristaluose susidariusios obligacijos skiriasi nuo kitų kristalų rūšių. Elektronai, kurie gali sudaryti ryšius, perkeliami per visą kristalinę struktūrą, kaip paaiškinta aukščiau.
Teorijos trūkumai
Metaliniuose atomuose yra nedidelis valentinių elektronų kiekis proporcingai jų energetiniam lygiui; ty yra daugiau galimų energijos būsenų nei susietų elektronų kiekis.
Tai reiškia, kad, kadangi yra stiprus elektroninis perkėlimas ir taip pat iš dalies užpildytos energijos juostos, elektronai gali judėti per tinklinę struktūrą, kai jie patenka į išorinį elektrinį lauką, o ne elektronų vandenyną. kuri palaiko tinklo pralaidumą.
Taigi metalų sąjunga aiškinama kaip teigiamai įkrautų jonų, susietų su elektronų jūra, konglomeratas (neigiamai įkrautas)..
Tačiau yra būdų, kurie nėra paaiškinti šiuo modeliu, pavyzdžiui, tam tikrų lydinių susidarymas tarp metalų su specifinėmis kompozicijomis arba kolektyvinių metalinių jungčių stabilumas, be kita ko..
Šiuos trūkumus paaiškina kvantinė mechanika, nes tiek ši teorija, tiek daugelis kitų metodų buvo nustatyti remiantis paprasčiausiu vieno elektrono modeliu, bandant taikyti daug sudėtingesnes daugiaelektroninių atomų struktūras..
Nuorodos
- Vikipedija. (2018). Vikipedija. Gauta iš en.wikipedia.org
- Holman, J. S. ir Stone, P. (2001). Chemija Gauta iš books.google.co.ve
- Parkin, G. (2010). Metalo ir metalo klijavimas. Gauta iš books.google.co.ve
- Rohrer, G. S. (2001). Kristalinių medžiagų struktūra ir klijavimas. Gauta iš books.google.co.ve
- Ibach, H. ir Lüth, H. (2009). Kietojo kūno fizika: įvadas į medžiagų mokslo principus. Gauta iš books.google.co.ve


