Sidabro sulfido (Ag2S) struktūra, savybės, nomenklatūra, panaudojimas
The sidabro sulfidas yra neorganinis junginys, kurio cheminė formulė yra Ag2S. Jis susideda iš juodai pilkšvosios kietosios medžiagos, susidarančios Ag katijonų+ ir anijonai S2- santykiu 2: 1. S2- tai labai panašus į Ag+, nes abu yra minkšti jonai ir jie sugeba stabilizuotis vienas su kitu.
Sidabriniai papuošalai yra linkę tamsinti, prarandant būdingą blizgesį. Spalvos pasikeitimas nėra sidabro oksidacijos rezultatas, bet jo reakcija su vandenilio sulfidu, esančiu aplinkoje esant mažai koncentracijai; Tai gali atsirasti dėl augalų, gyvūnų arba daug sieros turinčių maisto produktų puvimo ar skilimo.

H2S, kurio molekulėje yra sieros atomas, reaguoja su sidabru pagal šią cheminę lygtį: 2Ag (s) + H2S (g) => Ag2S (s) + H2(g)
Todėl Ag2S yra atsakingas už juodus sluoksnius, susidariusius ant sidabro. Tačiau gamtoje ši siera taip pat randama mineraluose „Acantita“ ir „argentita“. Šie du mineralai nuo daugelio kitų išsiskiria juodais ir ryškiais kristalais, kaip antai viršutiniame paveikslėlyje esantis kietas.
Ag2S pristato polimorfines struktūras, patrauklias elektronines ir optoelektronines savybes, yra puslaidininkis ir žada būti medžiaga fotovoltinių įrenginių, pvz., Saulės elementų, kūrimui.
Indeksas
- 1 Struktūra
- 2 Ypatybės
- 2.1 Molekulinė masė
- 2.2 Išvaizda
- 2.3 Kvapas
- 2.4 Lydymosi temperatūra
- 2.5 Tirpumas
- 2.6 Struktūra
- 2.7 Lūžio rodiklis
- 2.8 Dielektrinė konstanta
- 2.9 Elektronika
- 2.10 Redukcijos reakcija
- 3 Nomenklatūra
- 3.1 Sistematika
- 3.2 Atsargos
- 3.3 Tradicinė
- 4 Naudojimas
- 5 Nuorodos
Struktūra
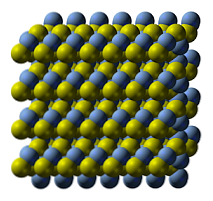
Viršutiniame paveikslėlyje parodyta sidabro sulfido kristalinė struktūra. Mėlynos spalvos sferos atitinka Ag katijonus+, o geltonieji - anijonai S2-. Ag2S yra polimorfinis, o tai reiškia, kad tam tikromis temperatūros sąlygomis jis gali priimti kelias kristalines sistemas.
Kaip? Per pereinamąjį etapą. Jonai pertvarkomi taip, kad temperatūros padidėjimas ir kietosios medžiagos vibracija nesutrikdytų elektrostatinio traukos ir atbaidymo pusiausvyros. Kai taip atsitinka, sakoma, kad yra fazinis perėjimas, todėl kieta medžiaga pasižymi naujomis fizinėmis savybėmis (pvz., Blizgesiu ir spalva)..
Ag2S esant normaliai temperatūrai (žemiau nei 179 ° C), ji turi monoklininę kristalinę struktūrą (α- Ag2S). Be šios kietosios fazės yra dar du: bcc (kubinis centre) nuo 179 iki 586 ° C, o fcc (kubinis centruotas veiduose) esant labai aukštai temperatūrai (δ- Ag2S).
Argentito mineralas susideda iš fcc fazės, taip pat žinomas kaip β-Ag2S. Atšaldžius ir transformavus į uolą, vyrauja jų struktūrinės savybės. Todėl abi kristalinės struktūros egzistuoja kartu: monoklinika ir bcc. Taigi atsiranda juodos kietos medžiagos su ryškiais ir įdomiais užrašais.
Savybės
Molekulinė masė
247,80 g / mol
Išvaizda
Pilki juodi kristalai
Kvapas
Tualetas.
Lydymosi temperatūra
836ºC. Ši vertė sutampa su tuo, kad Ag2S yra junginys, turintis mažai jonų ir todėl tirpsta žemesnėje kaip 1000 ° C temperatūroje.
Tirpumas
Vandenyje tik 6,21 ∙ 10-15 g / L 25 ° C temperatūroje. Tai reiškia, kad juoda kieta medžiaga, kuri yra tirpinama, yra nereikšminga. Tai dar kartą atsitiko dėl mažo poliarinio Ag-S ryšio požymio, kur nėra reikšmingo skirtumo tarp abiejų atomų elektronegatyvumo.
Taip pat „Ag“2S yra netirpus visuose tirpikliuose. Nė viena molekulė negali efektyviai atskirti kristalinių sluoksnių Ag jonuose+ ir S2- solvatas.
Struktūra
Keturi S-Ag-S jungčių sluoksniai taip pat gali būti matomi konstrukcijos paveiksle, kurie perkelia vienas kitą, kai kietoji medžiaga yra suprantama. Šis elgesys reiškia, kad, nepaisant to, kad jis yra puslaidininkis, jis yra panašus į daugelį metalų kambario temperatūroje.
S-Ag-S sluoksniai tinkamai tinka dėl jų kampinių geometrijų, kurios pastebimos kaip zigzagas. Turėdami supratimo jėgą, jie juda ant poslinkio ašies, todėl atsiranda naujų ne kovalentinių sidabro ir sieros atomų sąveika..
Lūžio rodiklis
2.2
Dielektrinė konstanta
6
Elektronika
Ag2S yra amfoterinis puslaidininkis, ty jis elgiasi taip, lyg jis būtų tokio tipo n ir tipo p. Jis taip pat nėra trapus, todėl jis buvo tiriamas jo naudojimui elektroniniuose įrenginiuose.
Redukcijos reakcija
Ag2S gali būti sumažintas iki metalinio sidabro, maudant juodus gabalus karštu vandeniu, NaOH, aliuminiu ir druska. Vyksta tokia reakcija:
3Ag2S (s) + 2Al (s) + 3H2O (l) => 6Ag (s) + 3H2S (ac) + Al2O3(-ai)
Nomenklatūra
Sidabras, kurio elektroninė konfigūracija yra [Kr] 4d105s1, jis gali prarasti tik vieną elektroną: jo atokiausių orbitų 5s. Taigi, Ag+ lieka elektronine konfigūracija [Kr] 4d10. Todėl jis turi unikalų +1 valentą, kuris lemia, kaip reikia vadinti jo junginius.
Kita vertus, siera turi elektroninę konfigūraciją [Ne] 3s23p4, ir reikia dviejų elektronų, kad užbaigtų valentų oktetą. Kai jis gauna šiuos du elektronus (iš sidabro), jis transformuojasi į sieros anijoną, S2-, su konfigūracija [Ar]. Tai reiškia, kad ji yra izoelektroninė prie argono tauriųjų dujų.
Taigi, kad Ag2S turi būti iškviestas pagal šias nomenklatūras:
Sistematika
Beždžionėsieros disidabras Čia mes atsižvelgiame į kiekvieno elemento atomų skaičių ir nurodomi graikų skaitiklių prefiksai.
Atsargos
Sidabro sulfidas. Jei unikalus +1 valentas, jis nenurodytas su romėniškais skaitmenimis skliausteliuose: sidabro sulfidas (I); kuri yra neteisinga.
Tradicinis
Sulfuro argéntico. Kadangi sidabras „veikia“ su +1 valencija, sufiksas -ico pridedamas prie jo pavadinimo argentum lotynų kalba.
Naudojimas
Kai kurie nauji „Ag“ naudojimo būdai2S yra šie:
-Jų nanodalelių (skirtingo dydžio) tirpalų spalvos, pasižymi antibakteriniu poveikiu, nėra toksiškos ir todėl gali būti naudojamos medicinos ir biologijos srityse..
-Jų nanodalelės gali sudaryti kvantinius taškus. Tai sugeria ir spinduliuoja didesnį intensyvumą nei daugelis organinių fluorescuojančių molekulių, todėl pastarieji gali juos pakeisti kaip biologinius žymenis.
-Α-Ag struktūros2Padarykite jį ryškiomis elektroninėmis savybėmis, kurios naudojamos kaip saulės elementai. Jis taip pat atspindi naujų termoelektrinių medžiagų ir jutiklių sintezę.
Nuorodos
- Mark Peplow. (2018 m. Balandžio 17 d.). Puslaidininkinis sidabro sulfidas plinta kaip metalas. Paimta iš: cen.acs.org
- Bendradarbiavimas: III / 17E-17F-41C () sidabro sulfido (Ag2S) kristalinės struktūros autoriai ir redaktoriai. In: Madelung O., Rössler U., Schulz M. (red.) „Ne Tetrahedrally Bonded Elements“ ir „Binary Compounds“ I. Landolt-Börnstein - III grupė kondensuota medžiaga (skaitiniai duomenys ir funkciniai ryšiai mokslo ir technologijų srityje), 41C. Springer, Berlynas, Heidelbergas.
- Vikipedija. (2018). Sidabro sulfidas. Paimta iš: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (2016 m. Liepos mėn.). Ag2S sidabro sulfido nanodalelės ir koloidiniai tirpalai: sintezė ir savybės. Paimta iš: sciencedirect.com
- Azo medžiagos. (2018). Sidabro sulfidas (Ag2S) Puslaidininkiai. Paimta iš: azom.com
- A. Nwofe. (2015). Sidabro sulfido plonų plėvelių perspektyvos ir iššūkiai: apžvalga. Medžiagų mokslo ir atsinaujinančios energijos skyrius, Industrinės fizikos katedra, Ebonyi valstybinis universitetas, Abakaliki, Nigerija.
- UMassAmherst. (2011). Paskaitų demonstravimas: valymas sudrėkintas. Paimta iš: lecturedemos.chem.umass.edu
- Tyrimas. (2018). Kas yra sidabro sulfidas? - Cheminė formulė ir naudojimo būdai. Paimta iš: study.com


