Aliuminio sulfidas (Al2S3) Cheminė struktūra, nomenklatūra, savybės
The aliuminio sulfidas (Al2S3) yra šviesiai pilkas cheminis junginys, susidaręs oksiduojant metalinį aliuminį prarandant paskutinio energijos lygio elektronus ir tapusiais katijonais, ir sumažinant nemetalinę sierą, laimėdamas aliuminio gaunamus elektronus ir tapusiais anijonas.
Kad tai įvyktų, ir aliuminis gali duoti savo elektronus, būtina pateikti tris hibridinius orbitinius sp3, tai suteikia galimybę formuoti ryšius su sieros elektronais.

Aliuminio sulfido jautrumas vandeniui reiškia, kad esant vandens garams ore, jis gali reaguoti, kad gautų aliuminio hidroksidą (Al (OH)).3), vandenilio sulfidas (H2S) ir vandenilis (H2dujiniai; jei pastaroji kaupiasi, tai gali sukelti sprogimą. Todėl aliuminio sulfido pakuotė turi būti pagaminta naudojant sandarias talpyklas.
Kita vertus, kadangi aliuminio sulfidas reaguoja su vandeniu, tai tampa elementu, kuris neturi tirpumo minėtame tirpiklyje.
Indeksas
- 1 Cheminė struktūra
- 1.1 Molekulinė formulė
- 1.2 Struktūrinė formulė
- 2 Ypatybės
- 2.1 Fizinės savybės
- 2.2 Cheminės savybės
- 3 Naudojimas ir taikymas
- 3.1 Superkondensatoriuose
- 3.2 Antrinėse ličio baterijose
- 4 Rizika
- 4.1 Pirmosios pagalbos procedūra
- 4.2 Priešgaisrinės priemonės
- 5 Nuorodos
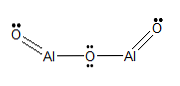
Cheminė struktūra
Molekulinė formulė
Al2S3
Struktūrinė formulė
- Aliuminio sulfidas.
- Di aliuminio trisulfidas.
- Aliuminio sulfidas (III).
- Aliuminio sulfidas.
Savybės
Cheminiai junginiai dažniausiai pasižymi dviejų rūšių savybėmis: fiziniu ir cheminiu.
Fizinės savybės
Molinė masė
150,158 g / mol
Tankis
2,02 g / ml
Lydymosi temperatūra
1100 ° C
Tirpumas vandenyje
Netirpi
Cheminės savybės
Viena iš pagrindinių aliuminio sulfido reakcijų yra su vandeniu, substratu arba pagrindiniu reagentu:

Šioje reakcijoje galima stebėti aliuminio hidroksido ir vandenilio sulfido susidarymą, jei jis yra dujų arba vandenilio sulfido pavidalu, jei jis yra ištirpintas vandenyje. Jo buvimas nustatomas pagal supuvusių kiaušinių kvapą.
Naudojimas ir taikymas
Superkondensatoriuose
Aliuminio sulfidas naudojamas gaminant nano tinklų struktūras, kurios pagerina specifinį paviršiaus plotą ir elektrinį laidumą taip, kad būtų pasiektas didelis talpumas ir energijos tankis, kurių pritaikomumas yra superkondensatoriai..
Grafeno oksidas (GO) - grafenas yra viena iš alotropinių anglies formų - buvo aliuminio sulfido (Al2S3) su hierarchine morfologija, panašia į nano-montaną, pagamintą naudojant hidroterminį metodą.
Grafeno oksido poveikis
Grafeno oksido kaip atramos, taip pat didelio elektrinio laidumo ir paviršiaus ploto savybės daro „nanorambutantu“ Al2S3 būti elektrochemiškai aktyvūs.
CV specifiniai talpumo kreivės su gerai apibrėžtomis redokso smailėmis patvirtina nanorambutanų Al pseudo-talpinį elgesį2S3 hierarchinė, palaikoma grafeno oksidu 1M NaOH elektrolitu. Specialios CV talpos vertės, gautos iš kreivių, yra: 168,97, kai skenavimo greitis yra 5 mV / s.
Be to, buvo pastebėtas geras 903 μs galvanostatinio išsikrovimo laikas, didelė 2178,16 talpa esant 3 mA / Cm srovės tankiui.2. Galvanostatinio išleidimo metu apskaičiuotas energijos tankis yra 108,91 Wh / kg, esant srovės tankiui 3 mA / Cm2.
Taigi elektrocheminė varža patvirtina hierarchinės nano-kolibro elektrodo pseudo-talpinį pobūdį2S3. Elektrodo stabilumo bandymas rodo, kad specifinis talpa iki 1000 ciklų yra 57,44%.
Eksperimentiniai rezultatai rodo, kad nanorambutantas Al2S3 Hierarchinis tinka superkondensatoriams.
Antrinėse ličio baterijose
Siekiant sukurti ličio antrinį akumuliatorių su dideliu energijos tankiu, aliuminio sulfidas (Al2S3) kaip aktyvią medžiagą.
Pradinis išleidimo pajėgumas, matuojamas nuo Al2S3 buvo maždaug 1170 mAh g-1 esant 100 mA g-1. Tai atitinka 62% teorinio sieros kiekio.
Al2S3 pasižymėjo prastos talpos sulaikymo potencialu diapazone nuo 0,01 V iki 2,0 V, daugiausia dėl įkrovimo proceso arba Li ekstrakcijos struktūrinio negrįžtamumo..
Aliuminio ir sieros XRD ir K-XANES tyrimai parodė, kad Al2S3 pakrovimo ir iškrovimo metu reaguoja grįžtamai, o „Al“ branduolys2S3 parodė struktūrinį negrįžtamumą, nes LiAl ir Li2S buvo suformuoti iš Al2S3 pradiniame atsisiuntime ir tada jie liko taip, kaip jie buvo.
Rizika
- Susilietus su vandeniu, išsiskiria degios dujos, kurios gali degti savaime.
- Sukelia odos dirginimą.
- Sukelia smarkų akių dirginimą.
- Gali sukelti kvėpavimo takų dirginimą.
Informacija gali skirtis priklausomai nuo priemaišų, priedų ir kitų veiksnių.
Pirmosios pagalbos procedūra
Bendras gydymas
Jei simptomai išlieka, kreipkitės į gydytoją.
Specialus gydymas
Nėra
Svarbūs simptomai
Nėra
Įkvėpimas
Paimkite nukentėjusįjį lauke. Jei sunku kvėpuoti, tiekkite deguonį.
Nurijimas
Įdėkite vieną ar dvi stiklines vandens ir sukelia vėmimą. Niekada nesukelkite vėmimo ar nieko neduokite į burną sąmonės neturinčiam asmeniui.
Oda
Nuplaukite pažeistą vietą vandeniu ir švelniu muilu. Pašalinkite visus užterštus drabužius.
Akys
Nuplaukite akis vandeniu, dažnai mirksi keletą minučių. Išimkite kontaktinius lęšius, jei jie yra, ir toliau skalauti.
Priešgaisrinės priemonės
Degumas
Nedegus.
Gesinimo priemonės
Reaguoja su vandeniu. Nenaudokite vandens: naudokite CO2, smėlį ir gesinimo miltelius.
Kova su procedūra
Naudokite pilną veidą turinčią autonominę kvėpavimo aparatą su visa apsauga. Dėvėti drabužius, kad išvengtumėte sąlyčio su oda ir akimis.
Nuorodos
- Salud y Riesgos.com, (s.f), Apibrėžimas, sąvokos ir straipsniai apie sveikatą, riziką ir aplinką. Atkurta: saludyriesgos.com
- Aliuminio sulfidas. (s.f) „Wikiwand“. Gauta 2018 m. Kovo 9 d .: wikiwand.com
- Web Elements. (S.f) .Dialuminium Trisulpfide, susigrąžintas 2018 m. Kovo 10 d.: Webelements.com
- Iqbal, M., Hassan, M., M., Bibi.S., Parveen, B. (2017). Aukšto specifinio pajėgumo ir sintezuoto grafeno oksido pagrindu pagaminto hiperarchinio Al2S3 nanorambutano energijos tankis superkondensatoriui, Electrochimica Acta, 246 tomas ,Puslapiai 1097-1103
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). Aliuminio sulfido elektrocheminės savybės, naudojamos ličio gamyboje.Energijos šaltinių leidinys,195 tomas, 24 numeris, 8327-8330 puslapiai doi.org
- LTS Research Laboratories, Inc (2016), saugos duomenų lapas Aliuminio sulfidas: ltschem.com