Tirpiosios savybės, skirtumai su tirpikliu ir tirpikliu, pavyzdžiai
The tirpsta, sprendime,tai yra medžiaga, ištirpanti tirpiklyje. Paprastai tirpiklis yra mažesnis, ir gali būti kietas, skystas arba dujinis. Priešingai, tirpiklis yra didesnio kiekio tirpalo komponentas.
Pavyzdžiui, druskos vandenyje druska yra tirpsta ir vanduo yra tirpiklis. Tačiau ne visi tirpalai yra kieti arba tirpikliai yra skysti.

Šiuo požiūriu yra keletas galimų tirpiklių ir tirpiklių derinių: dujos skystyje, kietos medžiagos, skystis skystyje, skystis kietoje, kieta skysta arba kieta kieta medžiaga..
Norint atpažinti, kuris tirpalas yra tirpale, reikia atsižvelgti į du aspektus. Pirma, tirpiklis yra mažesnės dalies medžiaga. Be to, jis yra tas, kuris keičia savo fizinę būseną (kietą, skystą ar dujinę), kai jis yra integruotas į tirpalą.
Indeksas
- 1 Tirpalai, tirpikliai ir tirpikliai
- 2 Tirpiklio apibrėžimas
- 3 Charakteristikos
- 3.1 Tirpumas
- 3.2 Temperatūra
- 3.3 Tirpalo prisotinimas
- 3.4 Slėgis
- 3.5 Poliškumas
- 4 Skirtumai tarp tirpiklio ir tirpiklio
- 5 Tirpių pavyzdžiai
- 5.1. Solutosas dujinėje būsenoje
- 5.2 Solutos kietoje būsenoje
- 5.3. Solutos skystoje būsenoje
- 5.4 Solutosas, kurį galima naudoti namuose
- 6 Nuorodos
Tirpalai, tirpikliai ir tirpikliai
Chemijoje yra homogeniški mišiniai, kurie yra jų komponentai, suskirstyti į vienodas proporcijas jų turiniu. Vienas iš labiausiai paplitusių homogeninių mišinių rūšių yra tirpalai, kurie yra stabilūs dviejų ar daugiau medžiagų homogeniniai mišiniai, kai tirpiklis tirpsta tirpiklyje..
Tirpalai, tirpikliai ir tirpikliai yra stebimi kasdieninėse situacijose ir diapazone, kuris skiriasi nuo pramonės. Šios medžiagos, susidariusios iš mišinių, yra tyrimo objektas dėl jų esančių savybių ir tarp jų atsirandančių jėgų ir (arba) atrakcijų..
Tirpiklio apibrėžimas
Kaip minėta pirmiau, tirpiklis yra ta medžiaga, kuri ištirpsta į kitą, vadinama tirpikliu.
Paprastai tirpiklis turi mažesnę dalį ir gali atsirasti bet kurioje iš trijų medžiagų būsenų. Kai tirpalas pateikiamas tarp dviejų medžiagų, kurios yra toje pačioje fazėje, tai, kaip pasirinkti, kuris tirpiklis yra tirpiklis ir kuris yra tirpiklis, pasirinktas mažesne dalimi..
Tirpumo tirpumas priklausys nuo tirpumo. Tirpiklio temperatūra taip pat yra lemiamas veiksnys, kai reikia žinoti, ar yra tirpalo formavimo galimybė, nes kuo didesnė tirpiklio temperatūra, tuo didesnis tirpiklio kiekis, kurį galima ištirpinti.
Yra medžiagų, vadinamų paviršinio aktyvumo medžiagomis, kurios aukštesnėje temperatūroje tampa mažiau tirpios, tačiau jos yra išimtys ir atlieka tam tikrus vaidmenis.
Procesas, kai tirpiklis sąveikauja su tirpikliu, kad susidarytų tirpalas, yra apibrėžiamas kaip solvavimas, ir apima ryšius ir vandenilio tiltelius, be Van der Waals jėgų atrakcijų..
Savybės
Tirpikliai sudaro didžiulę cheminių medžiagų įvairovę skirtingose valstybėse, turi skirtingus tirpimo pajėgumus ir turi daug savybių, kurios vaidina svarbų vaidmenį formuojant homogeninius mišinius. Kai kurios pagrindinės tirpiklių savybės yra šios:
Tirpumas
Tirpumas yra junginio gebėjimas ištirpti kitoje medžiagoje. Šis gebėjimas glaudžiai susijęs su maišymu, o tai yra skysčio gebėjimas maišyti su konkrečiu; Jei negalite prisijungti, tai yra nesuderinamumas.
Maišymo intervalas yra didesnis nei konkretus skaičius, todėl galima teigti, kad viena medžiaga yra visiškai, iš dalies arba nesuderinama kitoje.
Tirpiosios tirpiosios medžiagos savybės priklauso nuo kitų veiksnių, kurie gali padidinti arba sumažinti šį pajėgumą dėl jų poveikio tarpmolekulinių jėgų pusiausvyrai, kuri susidaro tarp tirpių ir tirpiklių.
Dar mažiau tikėtinų savybių, pvz., Tirpalo lašelio dydis arba tvarka kristalo struktūroje, gali paveikti jų gebėjimą ištirpti.
Temperatūra
Sistemos, kurioje tirpsta tirpalas, temperatūra gali paveikti jo tirpumą: daugumai kietųjų medžiagų ir skysčių jie padidina jo tirpumą pagal temperatūros padidėjimą.
Priešingai, pastebėta, kad dujose yra sudėtingas elgesys, parodytas kaip mažesnis tirpumas vandenyje esant aukštesnėms temperatūroms, bet didesnis - organiniuose tirpikliuose..
Tirpalo prisotinimas
Tai vadinama tirpalo prisotinimu tiek, kiek tirpalas ištirpina tirpalą, vadinamą prisotintu tirpalu, kuris yra ištirpęs kuo daugiau tirpių. Nuo to momento pridėtas tirpiklis nusodins kaip pertekliaus panaudoto konteinerio apačioje; prieš tai, tirpalas vadinamas nesočiu.
Galima perduoti prisotinimo tašką ir toliau tirpinti tirpalą, tačiau tam reikia temperatūros padidėjimo. Tirpalas, kuriame yra perteklinio tirpalo ir kuris buvo šildomas, vadinamas pernelyg prisotintu tirpalu.
Slėgis
Slėgio pokyčiai paprastai nedaro įtakos kietųjų medžiagų ir skysčių tirpumui, išskyrus kai kuriuos išskirtinius atvejus (kalcio sulfato kaupimasis naftos vamzdžiuose), tačiau dujose jis yra lemiamas jų gebėjimo ištirpti veiksnys..
Tiesą sakant, dujų tirpumas tirpiklyje yra tiesiogiai proporcingas to dujų daliniam slėgiui minėtame tirpiklyje.
Poliškumas
Tiriant tirpumo gebą, yra lemiamas poliarizas; tirpiklis geriau ištirps tirpiklyje, turinčioje panašią cheminę struktūrą.
Pavyzdžiui, labai poliarinės arba hidrofilinės medžiagos bus labiau tirpios labai poliariniuose tirpikliuose, o jos bus beveik netirpios netolinėse medžiagose..
Panašiai tarpmolekulinės jėgos atlieka svarbų vaidmenį solvacijoje, o tirpiklio ištirpinimo lengvumas: didesnės dipolio-dipolio jėgos, vandenilio jungtys ir kitos jungtys, tuo didesnis tirpiklio gebėjimas ištirpti tirpsta ir sudaro tirpalą.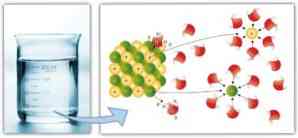
Tirpiklio ir tirpiklio skirtumai
- Tirpiklis yra ištirpusi medžiaga; tirpiklis yra tirpiklio (-ų) ištirpinimo priemonė..
- Tirpiklis gali būti kietoje, skystoje arba dujų fazėje; tirpiklis paprastai yra skystoje fazėje, bet taip pat yra kietoje ir dujinėje.
- Tirpių tirpumas labiau priklauso nuo tokių savybių kaip paviršius; Be kitų veiksnių, tirpiklio pajėgumas priklauso nuo poliškumo, temperatūros ir slėgio.
- Tirpiklis paprastai yra norimas komponentas, ekstrahuojamas pramoniniuose procesuose; Tirpiklis paprastai nėra pageidaujamas komponentas ir pašalinamas pramoniniuose procesuose.
Tirpių pavyzdžiai
- Cukrus yra kietos fazės tirpalo, paprastai naudojamo vandeniui saldinti, pavyzdys.
- Heksanas gali būti parafino vašku, tarnaujančiu kaip skystas tirpalas, dėl kurio ši kieta medžiaga tampa labiau formuojama.
- Anglies dioksidas - tai dujos, įdėtos į gėrimus, kad jie būtų švelnūs.
Solutos dujinėje būsenoje
Anglies dioksidas vandenyje (gaivieji gėrimai)
Anglies vanduo yra vanduo, kuriame yra anglies dioksido, ir gaunamas per vandenį patekus anglies dioksidui.
Gazuotas mineralinis vanduo ilgą laiką atsiranda natūraliai. Šie putojantys vandenys egzistuoja dėl per didelio anglies dioksido kiekio sluoksnyje ištirpusiame vandeningame sluoksnyje.
Vienas iš geriausiai žinomų tirpiklių pavyzdžių yra komerciniai gaivieji gėrimai, kurie yra derinami su sirupu.
Dėl anglies dioksido buvimo šie vandenys ir gaivieji gėrimai yra labiau patrauklūs ir vizualiai patrauklūs.
Deguonis ir kitos dujos azotu (ore)
Oras atmosferoje susideda iš skirtingų dujų molekulių. Jis iš esmės susideda iš 78% azoto ir apie 21% deguonies (tirpių). Be to, jame yra beveik 1% argono ir kitų molekulių, bet labai mažais kiekiais.
Propanas butane (virimo dujos)
Šis derinys, dar vadinamas suskystintomis naftos dujomis (LPG), pradėtas naudoti nuo 1860 m..
Nuo tada ji išplėtė savo gamybą ir vartojimą tiek vidaus, tiek pramoniniam naudojimui. Kadangi abi dujos yra labai bekvapės ir pavojingos, pridedama medžiaga, vadinama merkaptanu, dėl kurio atsiranda bet koks nuotėkis..
Solutos kietoje būsenoje
Vario cinkas (žalvaris)
Komercinį lydinį, žinomą kaip žalvaris, sudaro cinkas (nuo 5 iki 40%), ištirpintas varyje. Cinkas padeda padidinti tempimo stiprumą. Prie šio lydinio galima pridėti kitus elementus, tokius kaip alavo, geležies, aliuminio, nikelio ir silicio.
Jodas alkoholyje (jodo tinktūra)
Kitas populiariai žinomas tirpalo pavyzdys yra jodo tinktūra. Šiame tirpale yra jodo etilo alkoholyje (nuo 44 iki 50%). Jodo tinktūra naudojama kaip antiseptikas.
Druska vandenyje (jūros vanduo)
Jūros vanduo apima daugiau nei 70% Žemės paviršiaus. Tai kompleksinis 96,5% vandens, 2,5% druskų ir mažesnių kitų medžiagų kiekis. Tai apima neorganines ir ištirpusias organines medžiagas, daleles ir kai kurias atmosferos dujas.
Solutos skystoje būsenoje
Alkoholis vandenyje (alkoholiniai gėrimai)
Etanolis arba etilo alkoholis (tirpalas) nuo cukraus fermentacijos sumaišomas su vandeniu fiksuotomis proporcijomis, siekiant gaminti alkoholinius gėrimus.
Šis junginys lengvai virškinamas organizme, tačiau jo suvartojimas perteklius gali sukelti rimtą žalą sveikatai.
Vanduo ore (drėgmė ore)
Vanduo ore yra žinomas kaip rūkas. Tai sukelia nedideli vandens lašai, suspenduoti ore, ir iš esmės dėl žemės atšaldymo naktį.
Tokiu būdu šis aušinimas sukelia aplinkinį orą sumažinti jo temperatūrą. Tada šis reiškinys pasireiškia tada, kai į jį patenka kondensuotas vanduo.
Acto rūgštis vandenyje (actas)
Actas - tai skystis, turintis aštrią skonį, naudojamą prieskoniui papildyti arba maistui išsaugoti. Jis paruošiamas acto rūgšties tirpalu, sumaišytu su vandeniu.
Acto rūgšties koncentracija yra įvairi. Pavyzdžiui, distiliuoto acto dalis sudaro nuo 5 iki 8%.
Gyvsidabris sidabre (amalgamos arba dantų užpildai)
Dantų užpildams naudojamos amalgamos sudaro 2% gyvsidabrio su lydiniu, kuris veikia kaip tirpiklis. Šiame lydinyje yra 70% sidabro. Taip pat galite pridėti alavo, vario ir cinko.
„Solutos“, kurį galima naudoti namuose
Cukrus vandenyje
Cukrus yra molekulinis ir polinis junginys, todėl turi gebėjimą ištirpti vandenyje, kuris taip pat yra polinis elementas.
Cukraus struktūrizavimo būdas sukels išsisklaidymo procesą. Pvz., Jei cukrus yra gabalėliais, ištirpinti prireiks daugiau laiko nei grūduose.
Kai kurie ekspertai mano, kad vanduo su cukrumi yra labai svarbus kūno energijos šaltinis. Netgi buvo atlikti tyrimai, rodantys šio tirpalo veiksmingumą fizinio aktyvumo žmonėms.
Cukrus miltais
Paprastai ruošiant pyragą pirmiausia sumaišykite kietąsias medžiagas, tada įpilkite skysčių.
Cukrus yra tirpalas, kuris yra pritvirtintas prie miltų, dėl to gaunamas pagrindas maišui. Be šių dviejų sudedamųjų dalių, kiti pridedami vėliau, pavyzdžiui, kiaušiniai, sviestas arba vanilė.
Šis tirpalo tipas yra kietas, ir šiuo atveju jis sumaišomas su kietu tirpikliu. Gautas pagrindas gali būti naudojamas saldžiųjų duonos, sausainių, pyragų, kempinių, mažų pudingų ir daugelio kitų saldžių maisto produktų gamybai..
Sulčių milteliai vandenyje
Yra daug įvairių miltelių sulčių, kurios paruošiamos ištirpinant šį vandenį. Šiuo atveju tirpiklis yra sulčių milteliai ir tirpiklis yra vanduo.
Tirpiklio kiekis turi būti didesnis nei tirpių, todėl paprastai stikline vandens ištirpinama vienas ar du šaukštai sulčių. Netgi yra keletas miltelių, kurių koncentracija yra didesnė ir turėtų būti naudojamas mažesnis kiekis.
Šios sultys yra sunaikintos, nes jos rodo, kad jų sudedamosios dalys (pvz., Konservantai, stabilizatoriai ir saldikliai) kenkia sveikatai.
Chloras vandenyje
Vienas iš būdų, kaip išvalyti vandenį, yra naudoti vandenyje ištirpintą chlorą. Šis dezinfekantas yra vienas iš labiausiai naudojamų mikrobų šalinimo būdų, todėl geriausia, kad geriamąjį vandenį greitai, ekonomiškai ir lengvai paverstų geriamuoju vandeniu.
Chloras kaip šio tirpalo tirpalas turi būti įdedamas į vandenį ne didesnėje kaip 0,2 ir 0,5 miligramo litre koncentracijoje.
Naudojamo chloro kiekis turėtų būti labai mažas, nes ši medžiaga gali būti labai toksiška, kai ji suvartojama arba patenka į daugybę sumų.
Šis vandens valymo metodas yra žinomas kaip chloravimas, ir gali būti pritaikytas ekskursijos į kalną viduryje arba vandeniui gydyti namuose, siekiant pašalinti bakterijas ir mikrobus, kurie gali būti vamzdžiais, per kuriuos vanduo praeina..
Tapyba vandenyje
Vanduo yra labiausiai universalus tirpiklis, kuris yra ir yra pagrindas, kuriuo gali ištirpti tirpalas, pvz., Dažai.
Dažai dažai tirpsta dėl įvairių priežasčių. Dažniausiai siekiama palengvinti šepečių ir kitų įrankių, naudojamų dažymui, valymą.
Yra daug paveikslų tipų; Tie, kurie geriausiai ištirpsta vandenyje, yra latekso. Be to, kad leidžiama geriau valyti įrankius, dažų skiedimo vandenyje pranašumas prieš pradedant dažyti yra tai, kad užtikrins geresnį dažų paviršiaus apdailą.
Pieno milteliai vandenyje
Pieno milteliai yra tirpiklis, susidarantis dehidratuojant jau pasterizuotą pieną. Šio proceso tikslas - užtikrinti, kad pienas būtų ilgiau saugomas.
Šis tirpalas ištirpsta vandenyje ir sukuria skystą pieną, kuris paprastai pripildomas pusryčių metu, kartu su kava arba įvairiais preparatais.
Kaip ir sulčių miltelių atveju, atskiesto pieno kiekis turi būti mažesnis už vandens kiekį, kuriame norite paruošti tirpalą..
Ploviklis vandenyje
Plaunant drabužius, naudojami skysti arba milteliai. Jie ištirpinami vandenyje, kad susidarytų tirpalas, veikiantis kaip dezinfekavimo ir tekstilės audinių valiklis.
Tirpalo kiekis, kuris turi būti naudojamas šiame tirpale, yra įvairus, priklausomai nuo ploviklio tipo, tos pačios medžiagos ir jo sudedamųjų dalių..
Sprendimas, sudarytas iš ploviklio ir vandens, gali būti labai teršiantis, kai jis liečiasi su vandens sąvartynais, todėl patartina naudoti biologiškai skaidomus ploviklius, kurie per trumpą laiką gali pablogėti ir paveikti daug mažiau aplinkos..
Želatina
Želatina yra sausgyslių, raiščių ir gyvūnų kaulų elementas. Šis junginys gali būti milteliuose arba lapuose.
Abiem atvejais šis tirpalas turi būti ištirpintas karštame vandenyje, kad būtų pasiektas galutinis rezultatas: saldus maistas, idealiai tinka desertui ir daug naudos sveikatai.
Tarp šio junginio naudos yra tai, kad jis skatina greitą audinių atstatymą ir yra priešuždegiminis maistas. Be to, jis turi daug baltymų ir vaidina svarbų vaidmenį stiprinant imuninę sistemą.
Valgydami nedidelį želatinos kiekį, bus galima atkurti sąnarius ir taip numatyti osteoporozės atsiradimą.
Šokoladas piene
Šokoladas yra elementas, susidarantis dėl kakavos ir kakavos sviesto mišinio. Šis maistas veikia kaip tirpalas, sumaišytas su pienu, kad paruoštų tai, kas žinoma kaip karštas šokoladas.
Šiam preparatui reikia šildyti norimą pieno kiekį ir pridėti šokolado gabaliukais, milteliais arba skysčiu, nuolat maišant.
Taigi, kad šis tirpiklis ištirptų geriausiu įmanomu būdu ir būtų išvengta gabalėlių, būtina nugalėti mišinį be pauzės.
Kakavos milteliai vandenyje
Taip pat galite paruošti karštą šokoladą naudojant kakavos miltelius. Šis tirpalas susidaro tik iš kakavos miltelių masės. Skirtingai nuo šokolado, kakavoje nėra šio vaisiaus sviesto.
Kakava gali būti puikiai ištirpinta vandenyje, kad sukurtų šokolado skonio gėrimą. Tokiais atvejais labai svarbu saldinti mišinį su cukrumi, medumi arba kai kuriais saldikliais; kitaip rezultatas bus labai kartus.
Nuorodos
- Lambert, N. ir Mohammed, M. (1993). Chemija CXC. Oksfordas: Heinemann.
- Steen, D. P. (2008). Anglies dioksidas, karbonizacija ir pripildymo technologijos principai. D. P. Steen, Philip ir P. R. Ashurst (redaktoriai), „Carbonated Soft Drinks: Formulation and Manufacture“, p. 112-143. Oksfordas: „Blackwell Publishing“.
- Kas yra ore? (s / f). UCAR Mokslo švietimo centras. Gauta 2017 m. Spalio 17 d. Iš eo.ucar.edu
- Suskystintos naftos dujos. (2013 m. Liepos 12 d.). Encyclopædia Britannica.
Gauta 2017 m. Spalio 16 d. Iš britannica.com - Lytle, D. A. ir Schock, M. R. (1996). Stagnacijos laikas, kompozicija, PH ir Ortofosfato efektai metalo išpylimui iš žalvario. Ohajas: JAV Aplinkos apsaugos agentūra.
- Crabwee, T. D .; Pelletier, S.J. ir Pruett, T. L. (2001). Chirurginė antisepsija S. S. Block (redaktorius), dezinfekavimas, sterilizavimas ir konservavimas, pp. 919-934. Filadelfija: Lippincott Williams & Wilkins.
- Byrne, R. H. ir kt. (2017 m. Birželio 07 d.). Jūros vanduo. Encyclopædia Britannica. Gauta 2017 m. Spalio 17 d. Iš britannica.com
- Plutowska B. ir Wardencki, W. (2012). Alkoholinių gėrimų dujų chromatografija-olfaktometrija. J. Piggott (redaktorius), Alkoholiniai gėrimai: juslinis vertinimas ir vartotojų tyrimai, p.101-122. Filadelfija: Woodhead leidyba.
- Kas yra rūkas? (2017 m. Liepos 12 d.). Met Office (JK). metoffice.gov.uk
- Helmenstine, A. M ... (2016 m. Vasario 16 d.). Kokia yra cheminė acto sudėtis? Gauta 2017 m. Spalio 17 d., Iš thinkco.com
- Phinney, D. J. ir Halstead, J. H. (2017). Dantų pagalba: visapusiškas požiūris. Massachusetts: „Cengage Learning“.
- Britannica, E. (s.f.). Sprendimas-chemija Gauta iš britannica.com
- Vikipedija. (s.f.). Tirpumas. Gauta iš en.wikipedia.org
- Classzone (s.f.). Sprendimai. Gauta iš frsd.k12.nj.us
- ChemGuide. (s.f.). Sotieji tirpalai ir tirpumas. Gauta iš chem.libretexts.org
- Madhusha (s.f.). Skirtumas tarp tirpiklio ir tirpiklio. Gauta iš pediaa.com.


