Organinės druskos fizinės ir cheminės savybės, panaudojimas ir pavyzdžiai
The organinės druskos jie yra tankus jonų junginių skaičius su daugybe savybių. Anksčiau jie gaunami iš organinio junginio, kuris patyrė transformaciją, leidžiančią jam būti įkrovos nešikliu, ir kad jo cheminė tapatybė priklauso nuo susijusios jonų..
Žemiau esančiame paveikslėlyje parodyta dvi labai bendros cheminės formulės organinėms druskoms. Pirmasis, R-AX, yra interpretuojamas kaip junginys, kurio anglies struktūroje atomas arba A grupė turi teigiamą krūvį + arba neigiamą (-).
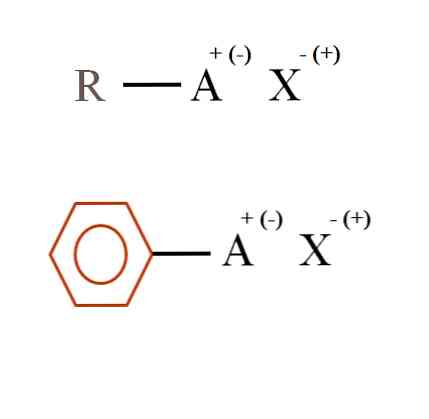
Kaip matyti, yra kovalentinis ryšys tarp R ir A, R-A, tačiau, savo ruožtu, A turi oficialų įkrovą, kuris pritraukia (arba atstumia) X joną. Įkrovimo ženklas priklausys nuo A pobūdžio ir cheminės aplinkos..
Jei A būtų teigiamas, kiek X gali su juo bendrauti? Turint tik vieną, atsižvelgiant į elektroneutralumo principą (+ 1-1 = 0). Tačiau kas yra X tapatybė? Anijonas X gali būti CO32-, reikia dviejų katijonų RA+; halogenidas: F-, Cl-, Br-, ir tt; arba netgi kitas RA junginys-. Pasirinktys yra neįmanoma.
Be to, organinė druska gali būti aromatinio pobūdžio, parodyta rudame benzeno žiede. Vario benzoato druska (II), (C6H5COO)2Pavyzdžiui, Cu susideda iš dviejų aromatinių žiedų su neigiamo krūvio karboksilo grupėmis, kurios sąveikauja su Cuation.2+.
Indeksas
- 1 Fizinės ir cheminės savybės
- 1.1 Aukštos molekulinės masės
- 1.2 Amfipilai ir paviršinio aktyvumo medžiagos
- 1.3 Aukštos virimo arba lydymosi vietos
- 1.4 Rūgštingumas ir bazingumas
- 2 Naudojimas
- 3 Organinių druskų pavyzdžiai
- 3.1 Karboksilatai
- 3.2 Ličio diacrylupratai
- 3.3 Sulfonio druskos
- 3.4 Okonio druskos
- 3.5 Amino druskos
- 3.6 Diazonio druskos
- 4 Nuorodos
Fizinės ir cheminės savybės
Iš paveikslėlio galima teigti, kad organinės druskos susideda iš trijų komponentų: organinio, R arba Ar (aromatinio žiedo), atomo arba grupės, turinčios joninį krūvį A, ir antioną X.
Kaip cheminė tapatybė ir struktūra yra apibrėžti tokiais komponentais, todėl jų savybės priklauso nuo jų.
Iš to galima apibendrinti tam tikras bendras savybes, kurios atitinka didžiąją šių druskų dalį.
Didelės molekulinės masės
Darant prielaidą, kad organinės druskos yra mono- arba daugialypės neorganinės X anijoninės, paprastai joms yra daug didesnės molekulinės masės nei neorganinės druskos. Taip yra daugiausia dėl anglies skeleto, kurio paprastos C-C obligacijos ir jų vandenilio atomai daug prisideda prie junginio.
Todėl jie yra R arba Ar atsakingi už jų didelius molekulinius svorius.
Amfipilai ir paviršinio aktyvumo medžiagos
Organinės druskos yra amfifiliniai junginiai, ty jų struktūros turi ir hidrofilinius, ir hidrofobinius galus.
Kokie yra tokie kraštutinumai? R arba Ar reiškia hidrofobinį galą, nes jų C ir H atomai neturi didelio afiniteto vandens molekulėms.
A+(-), atomas arba grupė, turinti įkrovą, yra hidrofilinis galas, nes jis prisideda prie dipolinio momento ir sąveikauja su vandens formavimo dipoliais (RA+ OH2).
Kai hidrofiliniai ir hidrofobiniai regionai yra poliarizuoti, amfifilo druska tampa paviršinio aktyvumo medžiaga, medžiaga, plačiai naudojama ploviklių gamybai ir demulsifikatoriai.
Aukštos virimo arba lydymosi vietos
Kaip ir neorganinės druskos, organinės druskos taip pat turi aukštus lydymosi ir virimo taškus dėl elektrostatinių jėgų, kurios reguliuoja skystą arba kietą fazę.
Tačiau turintys organinį komponentą R arba Ar, kitų tipų Van der Waals (Londono pajėgos, dipolio-dipolio, vandenilio tiltai), kurie tam tikru būdu konkuruoja su elektrostatiniais.
Dėl šios priežasties organinių druskų kietosios arba skystosios struktūros pirmiausia yra sudėtingesnės ir įvairesnės. Kai kurie iš jų net gali elgtis taip skystieji kristalai.
Rūgštingumas ir bazingumas
Organinės druskos paprastai yra stipresnės rūgštys arba bazės nei neorganinės druskos. Taip yra todėl, kad A, pvz., Amino druskose, turi teigiamą įkrovą dėl jo jungimosi su papildoma vandeniliu: A+-H. Tada, kontaktuodami su baze, paaukokite protoną, kad jis taptų neutraliu junginiu:
RA+H + B => RA + HB
H priklauso A, bet jis yra parašytas, kai įsijungia į neutralizavimo reakciją.
Kita vertus, RA+ ji gali būti didelė molekulė, nesugebanti susidaryti kietų medžiagų su kristaliniu tinklu, kuris pakankamai stabilus su hidroksilo anijonu arba hidroksilo OH-.
Tokiu atveju, druskos RA+OH- ji elgiasi kaip stipri bazė; net kaip bazinis, kaip NaOH arba KOH:
RA+OH- + HCl => RACl + H2O
Atkreipkite dėmesį į cheminę lygtį, kuri yra Cl anionas- ji pakeičia OH-, formuojant druską RA+Cl-.
Naudojimas
Organinių druskų naudojimas gali skirtis priklausomai nuo R, Ar, A ir X tapatybės. Be to, taikymas, kuriam jie skirti, priklauso nuo jų susidariusio kieto arba skysčio tipo. Tam tikri bendrieji aspektai yra šie:
-Jie naudojami kaip reagentai kitų organinių junginių sintezei. RAX gali veikti kaip „R“ grandinės „donoras“, pridedamas prie kito junginio, pakeičiančio gerą išeinančią grupę.
-Jos yra paviršinio aktyvumo medžiagos, todėl jos taip pat gali būti naudojamos kaip tepalai. Šiuo tikslu naudojamos karboksilatų metalinės druskos.
-Jie leidžia sintezuoti įvairius dažiklius.
Organinių druskų pavyzdžiai
Karboksilatai
Karboksirūgštys reaguoja su hidroksidu neutralizavimo reakcijoje, todėl susidaro karboksilatų druskos: RCOO- M+; kur M+ Tai gali būti bet koks metalinis katijonas (Na+, Pb2+, K+, ir tt) arba NH amonio katijonui4+.
Riebalų rūgštys yra ilgos grandinės alifatinės karboksirūgštys, jos gali būti prisotintos ir neprisotintos. Palmitino rūgštis (CH) yra tarp sočiųjų3(CH2)14COOH). Tai sukelia palmitato druską, o stearino rūgštį (CH3(CH2)16COOH sudaro stearato druską. Muilas yra sudarytas iš šių druskų.
Benzenkarboksirūgšties atveju C6H5COOH (kur C6H5- tai benzeno žiedas), kai jis reaguoja su baze, sudaro benzoato druskas. Visuose karboksilatuose -COO grupė- reiškia A (RAX).
Ličio diacupupratai
Ličio diacupratas yra naudingas organinei sintezei. Jo formulė yra [R-Cu-R]-Li+, kurioje vario atomas turi neigiamą krūvį. Čia varis yra atomo A atvaizdas.
Sulfonio druskos
Jie susidaro iš organinio sulfido reakcijos su alkilo halogenidu:
R2S + R'X => R2R'S+X
Šioms druskoms sieros atomas turi teigiamą formalų įkrovą (S+) turintys tris kovalentines obligacijas.
Oksono druskos
Be to, eteriai (sulfidų oksiduoti analogai) reaguoja su hidridais, kad susidarytų oksono druskos:
ROR '+ HBr <=> RO+HR '+ Br-
HBr rūgšties protonas yra kovalentiškai susietas su eterio deguonies atomu (R2O+-H), įkeliant jį teigiamai.
Amino druskos
Aminai gali būti pirminiai, antriniai, tretiniai arba ketvirtiniai, taip pat jų druskos. Visi jie pasižymi H atomu, susietu su azoto atomu.
Taigi, RNH3+X- tai yra pirminė amino druska; R2NH2+X-, antrinio amino; R3NH+X-, tretinio amino; ir R4N+X-, ketvirtinio amino (ketvirtinės amonio druskos) \ t.
Diazonio druskos
Galiausiai diazonio druskos (RN)2+X-) arba arildiazonio (ArN)2+X-) yra daugelio organinių junginių, ypač azodažiklių, pradinis taškas.
Nuorodos
- Francis A. Carey. Organinė chemija (Šeštasis leidimas, pp. 604-605, 697-698, 924). Mc Graw kalnas.
- Graham Solomons T.W., Craig B. Fryhle. Organinė chemija. Aminai (10-asis leidimas). Wiley Plus.
- Vikipedija. (2018). Druska (chemija). Paimta iš: en.wikipedia.org
- Steven A. Hardinger. (2017). Iliustruotas organinės chemijos žodynas: druskos. Gauta iš: chem.ucla.edu
- Chevron Oronite. (2011). Karboksilatai. [PDF] Gauta iš: oronite.com


