Broglie atominės modelio charakteristikos ir apribojimai
The Broglie atominis modelis 1924 m. pasiūlė prancūzų fizikas Louis Broglie. Savo disertacijoje Broglie patvirtino elektronų bangų dalelių dvilypumą, nustatydamas bangų mechanikos pamatus. Broglie paskelbė svarbias teorines išvadas apie medžiagos bangų korpuso pobūdį atomo skalėje.
Vėliau Broglie pareiškimus eksperimentiškai parodė mokslininkai Clinton Davisson ir Lester Germer, 1927 m. Broglie elektronų bangos teorija remiasi Einšteino pasiūlymu dėl šviesos bangų savybių trumpais bangos ilgiais.
Broglie pranešė apie galimybę, kad medžiaga turi panašų elgesį su šviesa, ir pasiūlė panašias subatominių dalelių, pvz..
Elektriniai krūviai ir orbitai riboja elektronų aprašytos bangos amplitudę, ilgį ir dažnį. Broglie paaiškino elektronų judėjimą aplink atominį branduolį.
Indeksas
- 1 Broglie atominio modelio charakteristikos
- 2 „Davisson“ ir „Germer“ eksperimentas
- 3 Apribojimai
- 4 Įdomūs straipsniai
- 5 Nuorodos
Broglio atominio modelio charakteristikos
Norėdami plėtoti savo pasiūlymą, Broglie pradėjo nuo principo, kad elektronai turėjo dvigubą pobūdį tarp bangų ir dalelių, panašių į šviesą.
Šia prasme Broglie palygino abu reiškinius ir, remdamasi Einšteino parengtomis lygtimis šviesos bangos pobūdžiui, nurodė:
- Bendra fotono energija ir, atitinkamai, bendra elektrono energija, gaunama iš bangos ir plokštės pastovumo dažnio (6.62606957 (29) × 10). -34 Jules x sekundės), kaip nurodyta toliau:
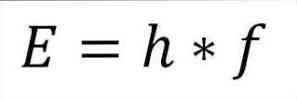
Šioje frazėje:
E = elektronų energija.
h = plokštė pastovi.
f = bangos dažnis.
- Fotono, taigi ir elektrono, linijinis momentas yra atvirkščiai proporcingas bangos ilgiui, ir abu dydžiai yra susiję su lentos konstanta:
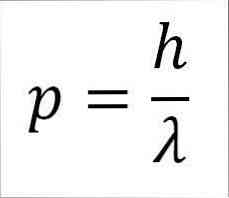
Šioje frazėje:
p = elektrono linijinis momentas.
h = plokštė pastovi.
λ = bangos ilgis.
- Linijinis impulsas yra dalelių masės rezultatas pagal greitį, kurį dalelė turi perkeliant.
Jei ankstesnė matematinė išraiška yra pertvarkyta kaip bangos ilgio funkcija, turime:
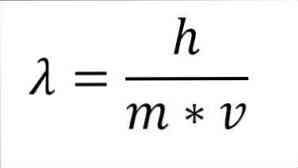
Minėta išraiška:
λ = bangos ilgis.
h = plokštė pastovi.
m = elektrono masė.
v = elektronų greitis.
Kadangi h, lentos konstanta, turi mažą reikšmę, taip pat yra bangos ilgis λ. Todėl galima teigti, kad elektrono bangų savybės atsiranda tik atominiuose ir subatominiuose lygmenyse.
- Broglie taip pat remiasi Bohr atominio modelio postulatais. Pastarųjų teigimu, elektronų orbitos yra ribotos ir gali būti tik sveikieji skaičiai. Taigi:
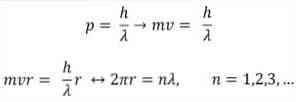
Kur:
λ = bangos ilgis.
h = plokštė pastovi.
m = elektrono masė.
v = elektronų greitis.
r = orbitos spindulys.
n = sveikas skaičius.
Pagal Bohr atominį modelį, kurį Broglie priėmė kaip pagrindą, jei elektronai elgiasi kaip nuolatinės bangos, vieninteliai leidžiami orbitai yra tie, kurių spindulys yra lygus integruotam bangos ilgio λ kartotiniui..
Todėl ne visi orbitai atitinka parametrus, reikalingus elektronui judėti per juos. Štai kodėl elektronai gali keliauti tik tam tikrose orbitose.
Broglie elektronų bangos teorija pateisino Bohr atominio modelio sėkmę paaiškindamas vieno vandenilio atomo elektrono elgesį.
Analogiškai jis taip pat atskleidė, kodėl šis modelis neatitiko sudėtingesnių sistemų, ty atomų, turinčių daugiau nei vieną elektroną.
Davisson ir Germer eksperimentas
Eksperimentinis Broglie atominio modelio patikrinimas įvyko praėjus 3 metams po jo paskelbimo 1927 m.
Žinomi amerikiečių fizikai Clinton J. Davisson ir Lester Germer eksperimentiškai patvirtino bangų mechanikos teoriją.
Davisson ir Germer atliko elektronų pluošto sklaidos bandymus per nikelio kristalą ir stebėjo difrakcijos fenomeną per metalinę terpę.
Atliktas eksperimentas buvo atlikti šią procedūrą:
- Pirmajame etape buvo surinktas su elektronų pluoštu, kuris turėjo žinomą pradinę energiją.
- Įrengtas įtampos šaltinis, kuris pagreitino elektronų judėjimą, sukeldamas potencialų skirtumą.
- Elektronų pluošto srautas buvo nukreiptas į metalinį kristalą; šiuo atveju nikelis.
- Išmatuotas nikelio kristalų paveiktų elektronų skaičius.
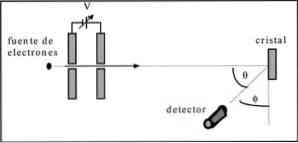
Eksperimento pabaigoje Davisson ir Germer nustatė, kad elektronai buvo išsklaidyti skirtingomis kryptimis.
Kartojant eksperimentą, naudojant metalo kristalus su skirtingomis kryptimis, mokslininkai nustatė:
- Elektronų pluošto sklaida per metalinį kristalą buvo panaši į šviesos spindulių trukdžių ir difrakcijos fenomeną..
- Elektronų atspindys ant smūginio kristalo apibūdino trajektoriją, kuri teoriškai turėtų aprašyti pagal Broglio elektronų bangų teoriją..
Sintezėje Davissono ir Germerio eksperimentas eksperimentiškai įrodė, kad elektronai yra dvigubos bangos dalelių.
Apribojimai
„Broglie“ atominis modelis neprognozuoja tikslios elektrono vietos orbitoje, kurioje jis juda.
Šiame modelyje elektronai suvokiami kaip bangos, judančios aplink orbitą be konkrečios vietos, kurioje įvedama elektroninės orbitos sąvoka..
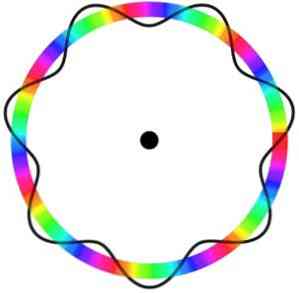
Be to, Broglio atominis modelis, panašus į Schrödingerio modelį, nemano, kad elektronai sukasi ant jo ašies (nugara).
Nepaisydami vidinio elektronų kampo, šių subatominių dalelių erdviniai variantai yra ignoruojami..
Ta pačia idėjų tvarka šis modelis neatsižvelgia į greito elektronų elgesio pokyčius dėl reliatyvistinio poveikio.
Interesų straipsniai
Schrödinger atomo modelis.
Chadwick atominis modelis.
Heisenbergo atominis modelis.
Perrino atomo modelis.
Thomson atominis modelis.
Daltono atominis modelis.
Dirac Jordano atominis modelis.
Demokratų atominis modelis.
Bohr atomo modelis.
Nuorodos
- „Bohr's Quantum Theory“ ir „De Broglie Waves“ (s.f.). Gauta iš: ne.phys.kyushu-u.ac.j
- Louis de Broglie - biografija (1929). © Nobelio fondas. Gauta iš: nobelprize.org
- Louis-Victor de Broglie (s.f.). Gauta iš: chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Gauta iš: britannica.com
- De Broglie atominis modelis. Nacionalinis nuotolinio mokymo universitetas. Ispanija Gauta iš: ocw.innova.uned.es
- Louis De Broglie medžiagos bangos (s.f.). Gauta iš: hiru.eus
- Von Pamel, O. ir Marchisio, S. (s.f.). Kvantinė mechanika Rosario nacionalinis universitetas. Gauta iš: fceia.unr.edu.ar


