Molekulinės geometrijos tipai ir pavyzdžiai
The molekulinė geometrija o molekulinė struktūra yra atomų aplink centrinį atomą erdvinis pasiskirstymas. Atomai reprezentuoja regionus, kuriuose yra didelis elektroninis tankis, todėl jie laikomi elektroninėmis grupėmis, neatsižvelgiant į tai, kokios nuorodos yra (vieno, dviejų ar trijų).
Ši koncepcija gimsta iš dviejų teorijų: valentinės jungties (TEV) ir valentinio apvalkalo (VSPR) elektroninių porų atbaidymo derinio ir eksperimentinių duomenų. Pirmasis apibrėžia nuorodas ir jų kampus, o antrasis nustato geometriją ir, atitinkamai, molekulinę struktūrą.

Kokios geometrinės formos yra molekulės, galinčios priimti? Dvi ankstesnės teorijos pateikia atsakymus. Pagal VSEPR, laisvų elektronų atomai ir poros turi būti išdėstytos erdvėje taip, kad būtų sumažintas jų elektrostatinis atbaidymas..
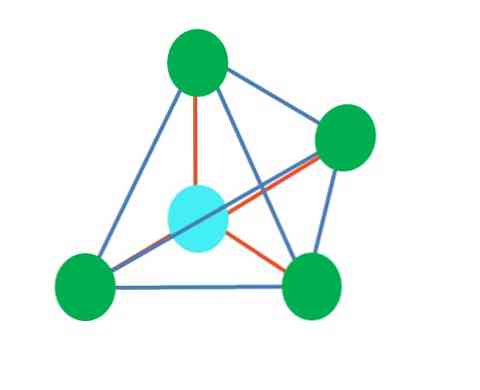
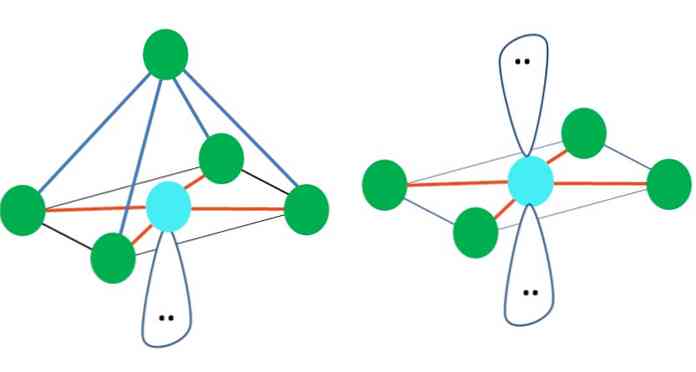
Taigi, geometrinės figūros nėra savavališkos, bet atrodo pačios stabiliausios. Pavyzdžiui, viršutiniame vaizde galima matyti trikampį į kairę, o oktaedrą - į dešinę. Žalieji taškai atspindi atomus ir oranžinės juostelės nuorodos.
Trikampyje trys žalieji taškai yra orientuoti į 120 °. Šis kampas, kuris yra lygus obligacijos kampui, leidžia atomai kuo mažiau atsikratyti vienas kito. Todėl molekulė su centriniu atomu, prijungtu prie trijų kitų, imsis trigoninės plokštumos geometrijos.
Tačiau VSCR prognozuoja, kad laisvas elektronų pora centrinėje atomo dalyje iškraipys geometriją. Trigoninės plokštumos atveju ši pora nuleis tris žaliuosius taškus, o tai sukels trigoninę piramidę.
Tas pats gali atsitikti ir su oktaedru. Jame visi atomai yra atskirti kuo stabiliausiu būdu.
Indeksas
- 1 Kaip iš anksto žinoti atomo X molekulinę geometriją?
- 2 tipai
- 2.1 Linijinis
- 2.2 Kampinis
- 2.3 Tetrahėras
- 2.4 Trigoninis bipiramidas
- 2.5 Octahedral
- 2.6 Kitos molekulinės geometrijos
- 3 Pavyzdžiai
- 3.1 Linijinė geometrija
- 3.2 Kampinė geometrija
- 3.3 Trigoninis planas
- 3.4 Tetrahėras
- 3.5 Trigoninė piramidė
- 3.6 trigoninis bipiramidas
- 3.7
- 3.8 T formos
- 3.9 Oktaedras
- 4 Nuorodos
Kaip iš anksto žinoti atomo X molekulinę geometriją?
Tam būtina atsižvelgti ir į elektroninių grupių laisvųjų elektronų poras. Šie, kartu su atomais, apibrėžs, kas vadinama elektroninė geometrija, kuri yra neatsiejama molekulinės geometrijos dalis.
Iš elektroninės geometrijos ir nustatę Lewis struktūros laisvųjų elektronų poras, galime nustatyti, kokia molekulinė geometrija bus. Visų molekulinių geometrijų suma suteiks pasaulinės struktūros kontūrą.
Tipai
Kaip matyti iš pagrindinio vaizdo, molekulinė geometrija priklauso nuo to, kiek atomų supa centrinį atomą. Tačiau jei elektronų pora yra be dalijimosi, ji pakeis geometriją, nes ji užima daug apimties. Todėl jis turi sterinį poveikį.
Pagal tai, geometrija gali pateikti daugelio molekulių būdingų formų seriją. Ir čia atsiranda įvairių molekulinės geometrijos ar molekulinės struktūros tipų.
Kada geometrija yra lygi struktūrai? Abi tos pačios žymimos tik tais atvejais, kai konstrukcija neturi daugiau kaip vienos geometrijos rūšies; kitaip turi būti atsižvelgta į visus esamus tipus ir struktūrą, kuri yra visuotinis (linijinis, šakotas, rutulinis, plokščias ir pan.).
Geometrijos yra ypač naudingos aiškinant kietosios medžiagos struktūrą iš struktūrinių padalinių.
Linijinis
Visos kovalentinės obligacijos yra nukreiptos, todėl ryšys A-B yra tiesinis. Bet ar AB molekulė bus linijinė?2? Jei taip, geometrija yra paprasčiausiai: B-A-B. Du B atomai yra atskirti 180 ° kampu, o pagal TEV, A turi turėti spibridinių orbitų.
Kampinis
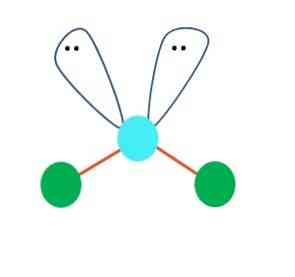
Pirmiausia galima manyti, kad AB molekulė yra tiesinė geometrija2; tačiau, norint padaryti išvadą, būtina atkreipti dėmesį į Lewis struktūrą. Brėžinant Lewio struktūrą, galima nustatyti elektronų porų skaičių be dalijimosi (:) ant A atomo.
Kai taip yra, elektronų porų viršuje jie duoda du B atomus, keisdami jų kampus. Todėl linijinė molekulė B-A-B tampa V, bumerangu arba kampine geometrija (viršutinis vaizdas)
Vandens molekulė H-O-H yra puikus šio tipo geometrijos pavyzdys. Deguonies atomo yra dvi elektronų poros be dalijimosi, kurios yra orientuotos maždaug 109 ° kampu.
Kodėl šis kampas? Kadangi elektroninė geometrija yra tetraedrinė, turinti keturi viršūniai: du H atomai ir du - elektronams. Pirmiau pateiktame paveikslėlyje pažymėkite, kad žalieji taškai ir du „skiltelės su akimis“ piešia tetretroną su mėlynais taškais jos centre.
Jei O neturėtų laisvų elektronų porų, vanduo sudarytų linijinę molekulę, jos poliškumas sumažėtų, o vandenynai, jūros, ežerai ir pan..
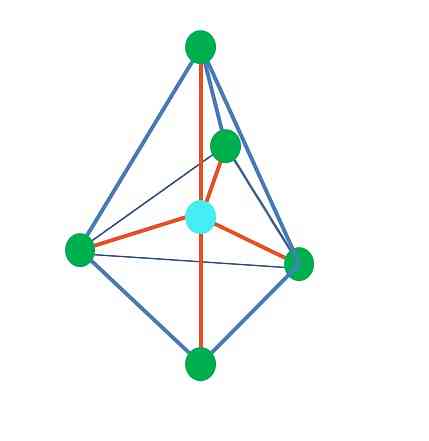
Tetrahedral
Viršutinis vaizdas yra tetraedrinės geometrija. Vandens molekulei jos elektroninė geometrija yra tetraedrinė, tačiau pašalinus be elektronų poras galima pastebėti, kad ji transformuojama į kampinę geometriją. Tai taip pat pastebima paprasčiausiai pašalinant du žalius taškus; likusieji du nubrėžia V su mėlynu tašku.
Ką daryti, jei vietoj dviejų porų laisvų elektronų buvo tik vienas? Tada būtų trigoninė plokštuma (pagrindinis vaizdas). Tačiau, pašalinus elektroninę grupę, nėra išvengta laisvųjų elektronų poros sukurto sterinio poveikio. Todėl jis iškreipia trigoninę plokštumą į trikampę pagrindinę piramidę:

Nors trigoninė ir tetraedrinė piramidė molekulinė geometrija yra skirtinga, elektroninė geometrija yra tokia pati: tetraedrinė. Taigi trigoninė piramidė nelaikoma elektronine geometrija?
Atsakymas yra ne, nes tai yra iškraipymo, kurį sukelia „skiltelė su akimis“, ir jos sterinio poveikio rezultatas, ir ši geometrija neatsižvelgia į vėlesnius iškraipymus.
Dėl šios priežasties visada svarbu nustatyti elektroninę geometriją Lewis struktūrų pagalba prieš apibrėžiant molekulinę geometriją. Amoniako molekulė, NH3, yra trigoninės piramidės molekulinės geometrijos pavyzdys, bet su tetraedrine elektronine geometrija.
Trigoninis bipiramidas
Iki šiol, išskyrus linijinę geometriją, kampinė ir trigoninė piramidė, jos centriniai atomai, turi hibridizaciją.3, pagal TEV. Tai reiškia, kad jei jūsų ryšių kampai buvo nustatyti eksperimentiškai, jie turėtų būti maždaug 109º.
Iš trigoninės dipiramidinės geometrijos yra centrinės atomo penkios elektroninės grupės. Viršutiniame paveikslėlyje galite pamatyti penkis žaliuosius taškus; trys trikampio pagrinde, o dvi ašinės pozicijos, kurios yra piramidės viršutinės ir apatinės viršūnės.
Kokį hibridizaciją turi mėlynas taškas? Tam reikia penkių hibridinių orbitų, kad būtų sudarytos paprastos obligacijos (oranžinės spalvos). Tai pasiekiama per penkias sp3d (orbitos s, trijų p ir a d mišinio produktas).
Apsvarstant penkias elektronines grupes, geometrija yra tokia, kuri jau yra eksponuojama, bet turinti elektronų poras be dalijimosi, šis vėl kenčia nuo iškraipymų, kurie sukuria kitas geometrijas. Taip pat kyla toks klausimas: ar šios poros gali užimti bet kokią vietą piramidėje? Tai yra: ašinis arba ekvatorinis.
Ašinės ir ekvatorinės pozicijos
Žalieji taškai, sudaryti iš trikampio pagrindo, yra lygiagretiose pozicijose, o du viršutiniame ir apatiniame galuose - ašinėse padėtyse. Kur, pageidautina, bus elektronų pora be dalijimosi? Tokioje padėtyje, kuri sumažina elektrostatinę atbaidymą ir sterinį poveikį.
Ašies padėtyje elektronų pora „statmenai“ (90 °) trikampio pagrindo pusėje, o jei ji būtų lygiagreti padėtyje, dvi likusios bazės elektroninės grupės būtų 120º, o abiejų galų - 90 ° (vietoj trys, kaip ir bazėje.
Todėl centrinis atomas stengsis orientuoti savo elektronų neturinčias poras vienodose pozicijose, kad sukurtų stabilesnes molekulines geometrijas.
Virpesinės ir T formos
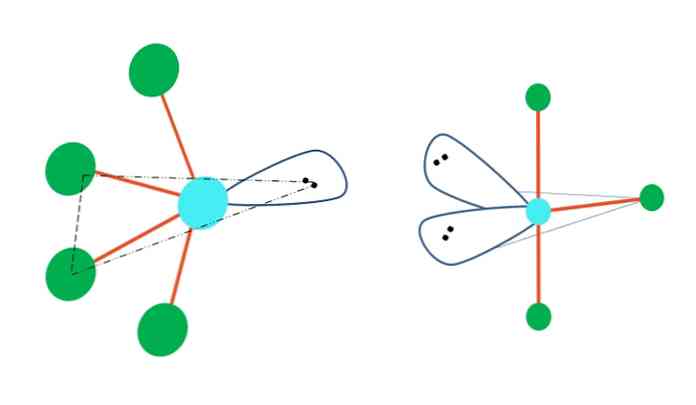
Jei trigoninė bipiramido geometrija pakeis vieną ar kelis jo atomus be elektroninių porų, ji taip pat turėtų skirtingas molekulines geometrijas.
Kairėje pusėje nuo viršutinio vaizdo geometrija keičiasi virpesių forma. Jame laisvos elektronų poros likusias keturias atomas pataiko į tą pačią kryptį, sulenkdami jų nuorodas į kairę. Atkreipkite dėmesį, kad ši pora ir du atomai yra toje pačioje trikampėje originalios dipiramido plokštumoje.
Ir dešinėje nuo vaizdo, T formos geometrijos Ši molekulinė geometrija yra dviejų atomų dviejų elektronų porų pakeitimo rezultatas, todėl likusieji trys atomai yra suderinti ta pačia plokštuma, kuri traukia tiksliai vieną raidę T.
Taigi, AB tipo molekulei5, ji priima trigoninę bipiramido geometriją. Tačiau, AB4, su ta pačia elektronine geometrija, ji priims svyruojančią geometriją; ir AB3, T formos geometrija, visuose A turi (paprastai) spibridizaciją3d.
Norint nustatyti molekulinę geometriją, reikia atkreipti Lewis struktūrą, taigi ir jos elektroninę geometriją. Jei tai yra trigoninis bipiramidas, tada elektroninės be poros bus pašalintos, bet ne jų sterinis poveikis kitiems atomams. Taigi galima puikiai atskirti tris galimas molekulines geometrijas.
Octahedral
Oktaedrinė molekulinė geometrija yra rodoma pagrindinio vaizdo dešinėje. Šis geometrijos tipas atitinka AB junginius6. AB4 jie sudaro kvadratinį pagrindą, o likę du B yra išdėstyti ašinėse padėtyse. Taigi suformuojami keli lygiakraščiai trikampiai, kurie yra oktaedro veidai.
Čia taip pat gali būti (kaip ir visose elektroninėse geometrijose) laisvos elektronų poros, todėl iš šio fakto kyla kitos molekulinės geometrijos. Pavyzdžiui, AB5 su oktaedrine elektronine geometrija susideda iš kvadrato pagrindo piramidės ir AB4 kvadratinės plokštumos:
Aštuntosios elektroninės geometrijos atveju šios dvi molekulinės geometrijos yra stabiliausios elektrostatinės atramos požiūriu. Kvadratinės plokštumos geometrijoje dvi elektronų poros yra 180 °.
Kokia yra hibridizacija šioms geometrijoms (ar struktūroms, jei ji yra vienintelė)? Vėlgi, TEV nustato, kad tai yra sp3d2, šešios hibridinės orbitos, leidžiančios A orientuoti elektronines grupes oktaedro viršūnėse.
Kitos molekulinės geometrijos
Pakeitus iki šiol paminėtų piramidžių bazes, galima gauti keletą sudėtingesnių molekulinių geometrijų. Pavyzdžiui, penkiakampis bipiramidas yra grindžiamas penkiakampiu ir junginiais, kurie sudaro bendrą AB formulę.7.
Kaip ir kitos molekulinės geometrijos, elektroninių be porų B atomų keitimas iškraipys geometriją į kitas formas.
Taip pat AB junginiai8 jie gali priimti tokias geometrines ypatybes kaip kvadratas. Kai kurios geometrijos gali būti labai sudėtingos, ypač AB formulėms7 (iki AB12).
Pavyzdžiai
Po to kiekvienai iš pagrindinių molekulinių geometrijų bus paminėta junginių serija. Kaip pratimą, galite atkreipti Lewis struktūras į visus pavyzdžius ir patvirtinti, ar, atsižvelgiant į elektroninę geometriją, jūs gaunate molekulines geometrijas, kaip nurodyta toliau..
Tiesinė geometrija
-Etilenas, H2C≡CH2
-Berilio chloridas, BeCl2 (Cl-Be-Cl)
-Anglies dioksidas, CO2 (O = C = O)
-Azotas, N2 (N≡N)
-Gyvsidabrio dibromidas, HgBr2 (Br-Hg-Br)
-Anijono trijodidas, I3- (I-I-I)
-Vandenilio cianidas, HCN (H-N≡C)
Jo kampai turi būti 180º, taigi jie turi turėti hibridizaciją.
Kampinė geometrija
-Vanduo
-Sieros dioksidas, SO2
-Azoto dioksidas, NO2
-Ozonas, O3
-Anion amiduro, NH2-
Trigoninė plokštuma
-Bromo trifluoridas, BF3
-Aliuminio trichloridas, AlCl3
-Nitrato anijonas, NO3-
-Anijonų karbonatas, CO32-
Tetrahedral
-Metano dujos, CH4
-Anglies tetrachloridas, CCl4
-Katijono amonio, NH4+
-Anijono sulfatas, SO42-
Trigoninė piramidė
-Amoniakas, NH3
-Katijono hidronis, H3O+
Trigoninis bipiramidas
-Fosforo pentafluoridas, PF5
-Antimonas Pentachloridas, SbF5
Skystas
Sieros tetrafluoridas, SF4
T forma
-Jodo trichloridas, ICl3
-Chlorido trifluoridas, ClF3 (abu junginiai yra žinomi kaip interhalogenai)
Octahedral
-Sieros heksafluoridas, SF6
-Seleno heksafluoridas, SeF6
-Heksafluorofosfatas, PF6-
Norėdami kulminuoti, molekulinė geometrija yra tai, kas paaiškina cheminių ar fizinių medžiagų savybes. Tačiau jis yra orientuotas pagal elektroninę geometriją, todėl pastarasis visada turi būti nustatytas prieš pirmąjį.
Nuorodos
- Whitten, Davis, Peck & Stanley. Chemija (8-asis red.). CENGAGE mokymasis, p. 194-198.
- Shiver & Atkins. (2008). Neorganinė chemija (Ketvirtas leidimas., P. 23, 24, 80, 169). Mc Graw kalnas.
- Mark E. Tuckerman. (2011). Molekulinė geometrija ir VSEPR teorija. Gauta iš: nyu.edu
- Virtuali Chembook, Charles E. Ophardt. (2003). Įvadas į molekulinę geometriją. Gauta iš: chemistry.elmhurst.edu
- Chemija LibreTexts. (2016 m. Rugsėjo 8 d.). Molekulių geometrija. Gauta iš: chem.libretexts.org


