Hidrobromido rūgšties (HBr) struktūra, savybės, panaudojimas
The Vandenilio bromido rūgštis yra neorganinis junginys, gaunamas iš vandeninio tirpalo, vadinamo vandenilio bromidu. Jo cheminė formulė yra HBr ir gali būti laikoma skirtingais būdais: molekuliniu hidridu arba vandenilio halogenidu vandenyje; tai yra hidrazidas.
Cheminėse lygtyse ji turėtų būti parašyta kaip HBr (ac), nurodant, kad tai yra vandenilio bromido rūgštis, o ne dujos. Ši rūgštis yra viena iš labiausiai žinomų, net daugiau nei druskos rūgštis, HCl. Tai paaiškina jo kovalentinio ryšio pobūdis.
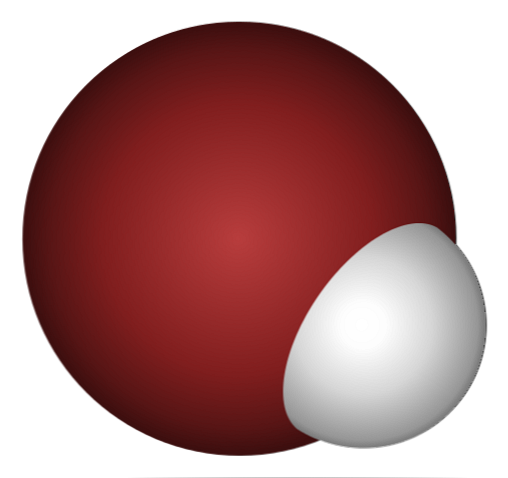
Kodėl HBr yra tokia rūgštis ir dar labiau ištirpsta vandenyje? Kadangi kovalentinė jungtis H-Br yra labai silpna dėl blogo Br ir H 4p orbitų persidengimo.
Tai nenuostabu, jei atidžiai žiūrite į aukščiau esantį vaizdą, kur aiškiai bromo atomas (rudas) yra daug didesnis nei vandenilio atomas (baltas).
Todėl bet koks trikdymas sukelia H-Br jungties suskilimą, atleidžiant H joną+. Tuomet vandenilio bromido rūgštis yra Brönsted rūgštis, nes ji perduoda protonus arba vandenilio jonus. Jo stiprumas yra toks, kad jis naudojamas daugelio organinių metalų junginių (pvz., 1-brometano, CH3CH2Br).
Hidrobromido rūgštis po hidro yra viena iš stipriausių ir naudingiausių hidridų tam tikrų kietų mėginių virškinimui.
Indeksas
- 1 Vandenilio bromido rūgšties struktūra
- 1.1 Rūgštingumas
- 2 Fizinės ir cheminės savybės
- 2.1 Molekulinė formulė
- 2.2 Molekulinė masė
- 2.3 Fizinė išvaizda
- 2.4 Kvapas
- 2.5 Kvapo slenkstis
- 2.6 Tankis
- 2.7 Lydymosi temperatūra
- 2.8 Virimo temperatūra
- 2.9 Tirpumas vandenyje
- 2.10 Garų tankis
- 2,11 pKa rūgštingumas
- 2.12 Kaloringumas
- 2.13 Standartinė molinė entalpija
- 2.14 Standartinis molinis entropija
- 2.15 Pliūpsnio temperatūra
- 3 Nomenklatūra
- 4 Kaip ji suformuota?
- 4.1 Vandenyje esantis vandenilio ir bromo mišinys
- 4.2 Fosforo tribromidas
- 4.3 Sieros dioksidas ir bromas
- 5 Naudojimas
- 5.1 Bromidų paruošimas
- 5.2 Alkilhalogenidų sintezė
- 5.3 Katalizatorius
- 6 Nuorodos
Vandenilio bromido rūgšties struktūra
H-Br struktūra parodyta paveikslėlyje, kurio savybės ir savybės, net ir dujų savybės, yra glaudžiai susijusios su jo vandeniniais tirpalais. Štai kodėl ateina taškas, kur jūs suprasite, kuris iš dviejų junginių yra susijęs su: HBr arba HBr (ac).
HBr (ac) struktūra skiriasi nuo HBr struktūros, nes dabar vandens molekulės tiria šią diatominę molekulę. Kai jis yra pakankamai arti, H perduodamas+ į H molekulę2Arba, kaip nurodyta šioje cheminėje lygtyje:
HBr + H2O => Br-- + H3O+
Taigi hidrobromido rūgšties struktūra susideda iš Br jonų-- ir H3O+ sąveikauja su elektrostatiniu būdu. Dabar tai šiek tiek skiriasi nuo kovalentinės H-Br jungties.
Jo didelis rūgštingumas priklauso nuo didelių anijonų Br- gali vos bendrauti su H3O+, negali trukdyti jam perkelti H+ į kitas aplinkines chemines rūšis.
Rūgštingumas
Pavyzdžiui, Cl- ir F- nors jie nesudaro kovalentinių ryšių su H3O+, jie gali sąveikauti per kitas tarpmolekulines jėgas, tokias kaip vandenilio tiltai (kuriuos tik F- gali priimti juos). Vandenilio tiltai F--H-OH2+ "Hinder" H+.
Dėl šios priežasties hidrofluorūgštis HF yra silpnesnė rūgštis vandenyje ne vandenilio bromido; nuo to laiko joninės sąveikos Br- H3O+ nesivarginkite H perdavimo+.
Tačiau nors HBr (ac) yra vandens, jo elgesys sąskaitos pabaigoje yra panašus į H-Br molekulės elgesį; tai yra H+ Jis perduodamas iš HBr arba Br-H3O+.
Fizinės ir cheminės savybės
Molekulinė formulė
HBr.
Molekulinė masė
80,972 g / mol. Atkreipkite dėmesį, kad, kaip minėta ankstesniame skyriuje, atsižvelgiama tik į HBr, o ne į vandens molekulę. Jei molekulinė masė yra paimta iš formulės Br-H3O+ ji būtų maždaug 99 g / mol.
Fizinė išvaizda
Bespalvis arba šviesiai geltonas skystis, kuris priklausys nuo ištirpusio HBr koncentracijos. Kuo daugiau geltona, tuo koncentruotesnė ir pavojingesnė.
Kvapas
Acrid, dirgina.
Kvapo slenkstis
6,67 mg / m3.
Tankis
1,49 g / cm3 (vandeninis tirpalas, esant 48% m / m). Ši vertė, kaip ir lydymo ir virimo temperatūros, priklauso nuo vandens, ištirpinto vandenyje, kiekio.
Lydymosi temperatūra
-11 ° C (12ºF, 393ºK) (vandeninis tirpalas, kurio masė sudaro 49%).
Virimo temperatūra
122 ° C (252 ° F. 393 ° K) esant 700 mmHg (vandeninis tirpalas 47-49% m / m).
Tirpumas vandenyje
-221 g / 100 ml (0 ° C temperatūroje).
-204 g / 100 ml (15 ° C).
-130 g / 100 ml (100 ° C).
Šios vertės reiškia dujinį HBr, o ne vandenilio bromido rūgštį. Kaip matyti, temperatūros didinimas mažina HBr tirpumą; elgesį, kuris yra natūralus dujose. Todėl, jei reikalingi koncentruoti HBr (ac) sprendimai, geriau dirbti su jais esant žemai temperatūrai.
Jei dirbate esant aukštai temperatūrai, HBr išnyks dujinių diatominių molekulių pavidalu, todėl reaktorius turi būti užsandarintas, kad būtų išvengta nuotėkio..
Garų tankis
2,71 (oro atžvilgiu = 1).
Rūgštingumas pKa
-9.0. Tai tokia neigiama konstanta rodo didelį rūgštingumo stiprumą.
Kaloringumas
29,1 kJ / mol.
Standartinė molinė entalpija
198,7 kJ / mol (298 K).
Standartinis molinis entropija
-36,3 kJ / mol.
Uždegimo taškas
Nedegus.
Nomenklatūra
Jo pavadinimas „hidrobromido rūgštis“ apjungia du faktus: vandens buvimą ir, kad bromo junginyje yra -1 valanda. Anglų kalba jis yra šiek tiek aiškesnis: vandenilio bromido rūgštis, kurioje priešdėlis „hidro“ (arba hidro) reiškia vandenį; nors, iš tikrųjų, jis taip pat gali būti susijęs su vandeniliu.
Bromas turi -1 valentą, nes jis yra susietas su vandenilio atomu mažiau elektroniniu požiūriu, nei yra; tačiau jei jis yra susietas arba sąveikauja su deguonies atomais, jis gali turėti daugybę valentų, tokių kaip: +2, +3, +5 ir +7. Su H gali priimti tik vieną valentą, todėl sufiksas -ico pridedamas prie jo pavadinimo.
Nors HBr (g), vandenilio bromidas, yra bevandenis; tai reiškia, kad joje nėra vandens. Todėl jis yra pavadintas pagal kitus nomenklatūros standartus, atitinkančius vandenilio halogenidų standartus.
Kaip ji susidaro?
Yra keletas sintetinių būdų, kaip paruošti vandenilio bromido rūgštį. Kai kurie iš jų yra:
Vandenyje esantis vandenilio ir bromo mišinys
Nenurodant techninių detalių, ši rūgštis gali būti gaunama tiesiogiai iš vandenilio ir bromo mišinio, pripildyto vandeniu.
H2 + Br2 => HBr
Tokiu būdu, kaip HBr formos, jis ištirpsta vandenyje; Tai gali vilkti jį į distiliavimą, todėl tirpalai gali būti ekstrahuojami skirtingomis koncentracijomis. Vandenilis yra dujos, o bromas - tamsiai rausvas skystis.
Fosforo tribromidas
Sudėtingesniame procese sumaišomas smėlis, hidratuotas raudonasis fosforas ir bromas. Vandens gaudyklės dedamos į ledo vonias, kad HBr nepatektų ir, o ne, susidarytų vandenilio bromido rūgštis. Reakcijos yra:
2P + 3Br2 => 2PBr3
PBr3 + 3H2O => 3HBr + H3PO3
Sieros dioksidas ir bromas
Kitas būdas jį paruošti yra bromo reagavimas su sieros dioksidu vandenyje:
Br2 + SO2 + 2H2O => 2HBr + H2SO4
Tai yra redoksinė reakcija. Br2 jis sumažėja, jis įgyja elektronų, susiejant su vandeniliais; o prieštaravimo pareiškimas2 ji oksiduoja, praranda elektronus, kai ji sudaro daugiau kovalentinių ryšių su kitais oksigenais, kaip ir sieros rūgštyje.
Naudojimas
Bromidų paruošimas
Bromido druskos gali būti paruoštos, jei HBr (ac) reaguoja su metalo hidroksidu. Pavyzdžiui, atsižvelgiama į kalcio bromido gamybą:
Ca (OH)2 + 2HBr => CaBr2 + H2O
Kitas pavyzdys yra natrio bromidas:
NaOH + HBr => NaBr + H2O
Taigi daugelis neorganinių bromidų gali būti paruošti.
Alkilo halogenidų sintezė
O kaip apie organinius bromidus? Tai organiniai metaliniai junginiai: RBr arba ArBr.
Alkoholių dehidratacija
Žaliava, kurią galima gauti, gali būti alkoholiai. Kai jie protonuojami pagal HBr rūgštingumą, jie sudaro vandenį, kuris yra geras išeinančios grupės, ir vietoj to yra įterptas erdvinis Br atomas, kuris taps kovalentiškai susietas su anglies:
ROH + HBr => RBr + H2O
Ši dehidratacija atliekama aukštesnėje nei 100 ° C temperatūroje, siekiant palengvinti R-OH jungties plyšimą2+.
Pridedama prie alkenų ir alkinų
HBr molekulę galima pridėti iš vandeninio tirpalo į alkeno arba alkino dvigubą arba trigubą jungtį:
R2C = CR2 + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Gali būti gaunami keli produktai, tačiau paprastomis sąlygomis produktas pirmiausia susidaro, kai bromas yra susietas su antriniu, tretiniu ar ketvirtiniu anglies dioksidu (Markovnikovo taisyklė)..
Šie halogenidai įsikiša į kitų organinių junginių sintezę, o jų panaudojimo spektras yra labai platus. Be to, kai kurie iš jų gali būti naudojami ir naujų vaistų sintezei ar projektavimui.
Eterinis clivage
Iš eterių vienu metu galima gauti du alkilhalogenidus, kiekvienas turi vieną iš dviejų pradinių eterio R-O-R 'šoninių grandinių R arba R'. Taip atsitinka kažkas panašaus į alkoholių dehidrataciją, tačiau jo reakcijos mechanizmas skiriasi.
Reakciją galima schematizuoti naudojant tokią cheminę lygtį:
ROR '+ 2HBr => RBr + R'Br
Ir taip pat išleidžiamas vanduo.
Katalizatorius
Jo rūgštingumas yra toks, kad jį galima naudoti kaip efektyvų rūgšties katalizatorių. Vietoj to, kad pridėtumėte Br anioną- į molekulinę struktūrą, atveria kelią kitai molekulei tai padaryti.
Nuorodos
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organinė chemija. Aminai (10)th leidimas.). Wiley Plus.
- Carey F. (2008). Organinė chemija (Šeštasis leidimas). Mc Graw kalnas.
- Steven A. Hardinger. (2017). Iliustruotas organinės chemijos žodynas: hidrombrūgštis. Gauta iš: chem.ucla.edu
- Vikipedija. (2018). Vandenilio bromido rūgštis. Gauta iš: en.wikipedia.org
- PubChem. (2018). Vandenilio bromido rūgštis. Gauta iš: pubchem.ncbi.nlm.nih.gov
- Nacionalinis darbų saugos ir higienos institutas. (2011). Vandenilio bromidas [PDF] Gauta iš: insht.es
- PrepChem. (2016). Vandenilio bromido rūgšties paruošimas. Gauta iš: prepchem.com


