Ketonų tipai, savybės, nomenklatūra, naudojimo būdai ir pavyzdžiai
The ketonai jie yra organiniai junginiai, turintys karbonilo grupę (-CO). Jie yra paprasti junginiai, kuriuose karbonilo grupės anglis yra prijungta prie dviejų anglies atomų (ir jų pakaitų grandinių). Ketonai yra "paprasti", nes jie neturi reaktyvių grupių, tokių kaip -OH arba -Cl, prijungto prie anglies.
Galiausiai, ketonų pašalinimas iš žmogaus kūno paprastai siejamas su mažu cukraus kiekiu (diabeto atvejais ir (arba) labai nevalgius), o tai gali sukelti sunkias sveikatos problemas pacientui..
Indeksas
- 1 Bendra ketonų formulė
- 2 Ketonų tipai
- 2.1 Pagal jūsų grandinės struktūrą
- 2.2 Pagal radikalų simetriją
- 2.3 Pagal radikalų prisotinimą
- 2.4 Dicetonai
- 3 Ketonų fizinės ir cheminės savybės
- 3.1 Virimo temperatūra
- 3.2 Tirpumas
- 3.3 Rūgštingumas
- 3.4 Reaktingumas
- 4 Nomenklatūra
- 5 Skirtumas tarp aldehidų ir ketonų
- 6 Naudojamas pramoninis ir kasdieninis gyvenimas
- 7 Ketonų pavyzdžiai
- 7.1 Butanonas (C4H8O)
- 7.2 Cikloheksanonas (C6H10O)
- 7.3 Testosteronas (C19H22O2)
- 7.4 Progesteronas (C21H30O2)
- 8 Nuorodos
Bendra ketonų formulė
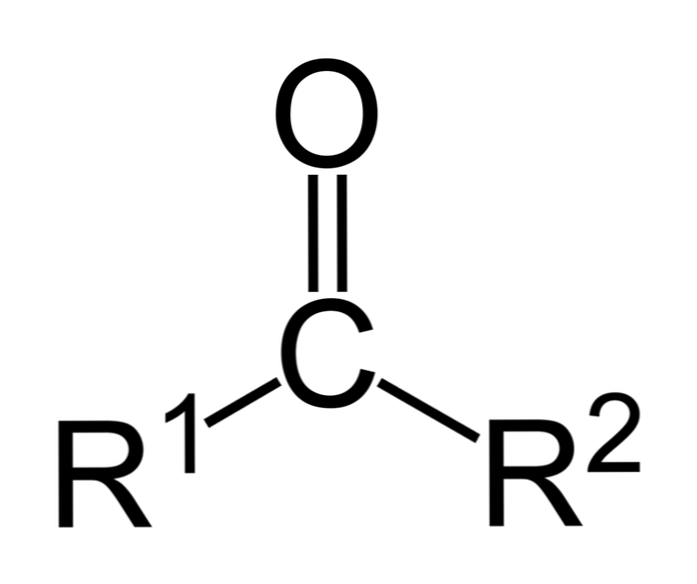
Ketonai yra karbonilo junginiai, kuriuose ši grupė yra prijungta prie dviejų angliavandenilių grupių; tai gali būti alkilo grupės, benzeno žiedo grupės arba abi.
Ketonas gali būti tiesiog pavaizduotas kaip R- (C = O) -R ’, kur R ir R’ yra bet kurios dvi angliavandenilių grandinės (alkanai, alkenai, alkinai, cikloalkanai, benzeno dariniai ir kt.). Nėra ketonų su vandeniliu, prijungtu prie karbonilo grupės.
Ketonų gamybai pramoninėje ir laboratorinėje aplinkoje yra daug įvairių metodų; Be to, svarbu pažymėti, kad ketonus gali sintezuoti įvairūs organizmai, įskaitant žmones.
Pramonėje labiausiai paplitęs ketonų sintezės metodas yra angliavandenilių oksidacija, paprastai naudojant orą. Nedideliu mastu ketonai paprastai gaminami oksiduojant antrinius alkoholius, kurie kaip produktus yra ketonas ir vanduo..
Be šių dažniausių metodų, ketonai gali būti sintezuojami per alkenus, alkinus, azoto junginių druskas, esterius ir daugelį kitų junginių, kurie leidžia juos lengvai gauti.
Ketonų tipai
Yra keletas ketonų klasifikacijų, daugiausia priklausomai nuo pakaitų jų grandinėse R. Toliau pateikiamos dažniausiai šių medžiagų klasifikacijos:
Pagal jūsų grandinės struktūrą
Tokiu atveju ketonas klasifikuojamas pagal jo grandinės struktūrą: alifatiniai ketonai yra tie, kuriuose yra du R ir R ’radikalai, turintys alkilo radikalų (alkanų, alkenų, alkinų ir cikloalkanų) formą.
Savo ruožtu aromatai yra tie, kurie sudaro benzeno darinius, vis dar yra ketonai. Galiausiai, mišrūs ketonai yra tie, kurie turi R alkilo radikalą ir R ’arilo radikalą, arba atvirkščiai.
Pagal radikalų simetriją
Šiuo atveju tiriami karbonilo grupės radikalai R ir R '; kai jie yra vienodi (identiški), ketonas vadinamas simetriniu; bet kai jie yra skirtingi (kaip ir dauguma ketonų), tai vadinama asimetrine.
Pagal radikalų prisotinimą
Ketonai taip pat gali būti klasifikuojami pagal jų anglies grandinių prisotinimą; Jei jie yra alkanų pavidalu, ketonas vadinamas prisotintu ketonu. Priešingai, jei grandinės randamos alkenais ar alkinais, ketonas vadinamas nesočiųjų ketonu.
Dicetonai
Tai yra atskira ketono klasė, nes šio ketono grandinės savo struktūroje turi dvi karbonilo grupes. Kai kurie iš šių ketonų turi unikalias savybes, pavyzdžiui, ilgesnį ryšį tarp anglies.
Pavyzdžiui, diketonai, gauti iš cikloheksano, yra žinomi kaip chinonai, kurie yra tik du: orto-benzokinonas ir para-benzokinonas.
Ketonų fizinės ir cheminės savybės
Ketonai, kaip ir dauguma aldehidų, yra skystos molekulės ir turi keletą fizinių ir cheminių savybių, kurios skiriasi priklausomai nuo jų grandinių ilgio. Jo savybės aprašytos toliau:
Virimo temperatūra
Ketonai yra labai lakūs, labai poliniai ir negali duoti vandenilio junginių vandeniliams (jie neturi vandenilio atomų, prijungtų prie jų karbonilo grupės), todėl jie turi aukštesnes virimo temperatūras nei alkenai ir eteriai, tačiau jie yra mažesni nei tos pačios molekulinės masės alkoholiai.
Ketono virimo temperatūra didėja, kai padidėja molekulės dydis. Taip yra dėl van der Waals jėgų ir dipolio-dipolio jėgų įsikišimo, kuriems reikia didesnio energijos kiekio, kad atskirtų molekules atomų ir elektronų atskyrimas..
Tirpumas
Ketonų tirpumas iš dalies turi didelę įtaką šių molekulių gebėjimui priimti deguonies atomą vandenilius ir taip sudaryti vandenilio ryšį su vandeniu. Be to, tarp ketonų ir vandens susidaro patrauklios, sklaidos ir dipolio-dipolio jėgos, kurios padidina jų tirpų poveikį.
Ketonai praranda tirpumą, tuo didesnė jų molekulė, nes jie pradeda reikalauti daugiau energijos, kad ištirptų vandenyje. Jie taip pat tirpsta organiniuose junginiuose.
Rūgštingumas
Karbonilo grupės dėka ketonai turi rūgšties pobūdį; taip atsitinka dėl šios funkcinės grupės rezonansų stabilizavimo pajėgumo, galinčio perkelti protonus iš dvigubos jungties, kad suformuotų konjuguotą bazę, vadinamą enol..
Reaktingumas
Ketonai yra daugelio organinių reakcijų dalis; taip atsitinka dėl to, kad jo karbonilo anglis yra jautrus nukleofiliniam papildymui..
Kaip minėta pirmiau, didelis ketonų reaktyvumas daro juos pripažintu tarpiniu produktu, kuris yra pagrindas kitų junginių sintezei.
Nomenklatūra
Ketonai yra pavadinti pagal karbonilo grupės prioritetą arba svarbą visoje molekulėje, todėl, kai turite karbonilo grupės valdomą molekulę, ketonas yra pavadintas pridedant priesaga „-one“ į angliavandenilio pavadinimą.
Ilgiausia grandinė su karbonilo grupe laikoma pagrindine grandine, o tada - molekulė. Jei karbonilo grupė neturi pirmenybės prieš kitas molekulės funkcines grupes, ji yra identifikuojama su "-oxo".
Sudėtingesniems ketonams funkcinės grupės padėtis gali būti identifikuojama su skaičiumi, o diketonų (ketonų, turinčių du identiškus R ir R 'pakaitus) atveju - molekulė su priesaga "-dionas"..
Galiausiai žodis „ketonas“ taip pat gali būti naudojamas identifikavus radikalų grandines, prijungtas prie karbonilo funkcinės grupės.
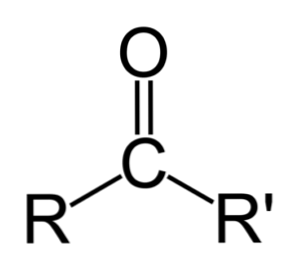
Skirtumas tarp aldehidų ir ketonų
Didžiausias skirtumas tarp aldehidų ir ketonų yra vandenilio atomas, prijungtas prie karbonilo grupės aldehiduose..
Šis atomas turi svarbų poveikį, kai kalbama apie molekulės įtraukimą į oksidacijos reakciją: aldehidas susidaro karboksirūgšties arba karboksirūgšties druskos, priklausomai nuo to, ar oksidacija vyksta rūgštinėse ar pagrindinėse sąlygose..
Priešingai, ketonas neturi tokio vandenilio, todėl minimalūs oksidacijai būtini žingsniai nevyksta.
Yra metodų, kaip oksiduoti ketoną (oksiduojančiais agentais, kurie yra daug galingesni, nei paprastai naudojami), tačiau jie sulaužo ketono molekulę, pirmiausia ją atskiriant į dvi ar daugiau dalių.
Naudojamas pramoninis ir kasdieninis gyvenimas
Pramonėje ketonai dažnai stebimi kvepaluose ir dažuose, atliekant stabilizatorių ir konservantų vaidmenis, kurie neleidžia kitiems mišinio komponentams žeminti; jie taip pat turi platų spektrą kaip tirpikliai tose pramonės šakose, kurios gamina sprogmenis, dažus ir tekstilę, be farmacijos.
Acetonas (mažiausias ir paprasčiausias ketonas) yra visame pasaulyje pripažintas tirpiklis, naudojamas kaip dažų valiklis ir skiediklis..
Gamtoje ketonai gali pasirodyti kaip cukrūs, vadinami ketozėmis. Ketozės yra monosacharidai, kurių molekulėje yra vienas ketonas. Geriausiai žinoma ketozė yra fruktozė, vaisiuose ir meduje randamas cukrus.
Riebalų rūgščių biosintezė, kuri vyksta gyvūnų ląstelių citoplazmoje, taip pat vyksta veikiant ketonams. Galiausiai, kaip minėta, gali būti, kad kraujyje po nevalgius ar diabetiniais atvejais kraujyje padidėja ketonai.
Ketonų pavyzdžiai
Butanonas (C4H8O)
Taip pat žinomas kaip MEK (arba MEC), šis skystis gaminamas dideliu mastu pramonėje ir naudojamas kaip tirpiklis.
Cikloheksanonas (C6H10O)
Šis ketonas gaminamas masiniu mastu kaip sintetinio nailono medžiagos pirmtakas.
Testosteronas (C) |19H22O2)
Tai pagrindinis vyrų lyties hormonas ir anabolinis steroidas, randamas daugelyje stuburinių gyvūnų.
Progesteronas (C) |21H30O2)
Endogeninis steroidas ir lytinis hormonas, susijęs su menstruaciniu ciklu, nėštumu ir embriogeneze žmonėms ir kitoms rūšims.
Nuorodos
- Vikipedija. (s.f.). Ketonas Gauta iš en.wikipedia.org
- Britannica, E. (s.f.). Ketonas Gauta iš britannica.com
- Universitetas, M. S. (s.f.). Aldehidai ir ketonai. Gauta iš chemistry.msu.edu
- ChemGuide. (s.f.). Aldehidų ir ketonų pristatymas. Gauta iš chemguide.co.uk
- Calgary, U. O. (s.f.). Ketonai. Gauta iš chem.ucalgary.ca


