Natrio bromido (NaBr) cheminė struktūra, savybės ir panaudojimas
The natrio bromido yra cheminė medžiaga, priklausanti neorganinės kilmės druskoms. Jo struktūra susideda iš bromo halogeno ir natrio metalo elemento santykiu 1: 1. Jo cheminė formulė yra NaBr ir yra kietos agregacijos esant standartinėms temperatūros ir slėgio sąlygoms (25 ° C ir 1 atm)..
Paprastai jį galima stebėti kaip baltą miltelį, ir jis laikomas kristalinio tipo junginiu, kuris taip pat pasireiškia higroskopiniu elgesiu; tai reiškia, kad jis turi galimybę sugerti drėgmę iš savo aplinkos.

Panašiai natrio bromido fizinės savybės labai panašios į kitą to paties metalo jonų junginį: natrio chloridą. Šis chloridas yra NaCl, kuris yra labiau žinomas kaip paprastoji druska arba valgomoji druska.
Ji turi daug naudos įvairiose mokslo srityse; pavyzdžiui, jis naudojamas įvairių rūšių vaistų (raminamųjų, migdomųjų, antikonvulsantų) gamybai, taip pat organinei sintezei ir net fotografavimo programoms.
Indeksas
- 1 Cheminė struktūra
- 1.1 Cheminė sintezė
- 2 Ypatybės
- 3 Naudojimas
- 4 Nuorodos
Cheminė struktūra
Kaip jau minėta, natrio bromidas atsiranda kietoje fazėje ir, kaip ir daugelis kitų neorganinio pobūdžio druskų, turi kristalinę struktūrinę konformaciją..
Ši kristalinė molekulė, susidedanti iš bromo atomo ir vandenilio atomo, turi kubinio tipo konformaciją, orientuotą į veidus, tokius kaip to paties metalo halogeninės druskos (NaI, NaF ir NaCl)..
Šis molekulinis išdėstymas sudaro daugelio junginių struktūrinį pagrindą, kuriame užsakymas atliekamas taip, kad kiekvienas jonas būtų laikomas oktaedrinio figūros centre, kaip parodyta šiame paveikslėlyje..
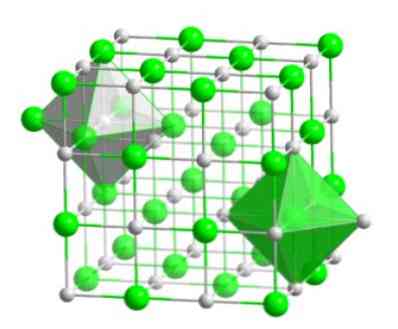
Šio tipo kristaluose galite pamatyti, kaip kiekvienas iš jonų turi aplink jį šešis kitus jonus, kurie turi priešingą elektros įkrovą, kurie yra oktaedrinio figūros galuose..
Be to, šios joninės medžiagos struktūra reiškia, kad jos lydymosi temperatūra yra maždaug 747 ° C ir yra komerciškai dviejų formų: bevandenė rūšis (be vandens molekulių) ir dihidruotos rūšys (su dviem vandens molekulėmis jo Struktūrinė formulė (NaBr · 2H2O)), kurių lydymosi taškai yra skirtingi.
Cheminė sintezė
Natrio bromidą sukelia cheminė reakcija, atsirandanti tarp vandenilio bromido (BrH, vandenilio halogenido dujų fazėje) ir natrio hidroksido (NaOH, stiprios bazės kietoje fazėje ir higroskopinių savybių)..
Tokiu būdu jis yra gaminamas komerciškai, pridedant bromo tirpalo į NaOH tirpalą. Tai sudaro bromido / bromo mišinį. Vėliau gauti produktai išgarinami iki džiovinimo ir apdorojami anglies pavidalu, kad susidarytų bromo jono redukcijos reakcija (BrO3-) į bromido joną (Br-).
Neutralizavimas
Panašiai ši neorganinė druska taip pat gali būti gaminama natrio karbonato neutralizavimo reakcija (Na2CO3) su bromo rūgštimi (HBrO)3), taikant tą pačią pirmiau aprašytą procedūrą.
Per sintezę šią medžiagą galima gaminti naudojant geležį su bromu ir vandeniu. Kaip šios reakcijos produktas yra geležies geležies bromido rūšys.
Vėliau ši rūšis susidarė (atstovaujama kaip FeBr2/ FeBr3) ištirpinamas vandenyje ir pridedamas tam tikras kiekis natrio karbonato. Galiausiai, tirpalas nufiltruojamas ir patenka į garinimo procesą, kad galiausiai būtų gautas natrio bromidas.
Savybės
- Jis paprastai randamas kietos agregacijos būsenoje, baltojo miltelių pavidalu.
- Jis turi kristalinę struktūrą, su kubo formos molekuliniu išdėstymu, kuris yra centruotas ant veidų.
- Šios medžiagos lydymosi temperatūra yra apie 747 ° C bevandenėje formoje ir 36 ° C, esant dihidruotai formai, ištirpstant prieš ištirpstant.
- Jį sudaro natrio jonas (Na+) ir bromido joną (Br-), kurių molinė masė arba molekulinė masė yra 102,89 g / mol.
- Jo virimo temperatūra yra gana didelė, stebint 1390 ° C temperatūroje (atitinka 2530 ° F arba 1660 K)..
- Šios rūšies tirpumas yra apie 94,32 g / 100 ml 25 ° C temperatūroje vandenyje, didėjant temperatūrai.
- Atliekant kaitinimą iki taško, kur jis suskaidomas, ši medžiaga išskiria toksiškas bromo ir natrio oksido dujas.
- Natrio bromido bevandenės formos tankis yra 3,21 g / cm3, o dihidrato junginio - 2,18 g / cm3.
- Jo tirpumas alkoholyje laikomas vidutiniu, kaip ir kituose tirpikliuose, tokiuose kaip piridinas, amoniakas ir hidrazinas.
- Jis turi netirpumą acetonitrilui ir acetonui.
Naudojimas
- Medicinos srityje jis naudojamas kaip vaistas daugeliui ligų, kurios sukelia traukulius ir gydo epilepsijos prevenciją pacientams, sergantiems Wolf-Hirschhorno sindromu, taip pat raminamuoju ir hipnotiniu gydymu..
- Veterinarinėje medicinoje naudojami šunys, turintys priepuolių sutrikimų dėl šalutinių reiškinių, pvz., Fenobarbitalio ar primidono..
- Naftos pramonės srityje jis naudojamas tam tikrų tankio skysčių, naudojamų naftos gręžiniuose, paruošimo procesuose.
- Biologinių tyrimų srityje įrodytos jo mikrobiocidinės savybės; tai yra, ji naudojama įvairių tipų bakterijų vystymuisi kontroliuoti.
- Tam tikrose organinės rūšies sintezėse ši neorganinio pobūdžio druska naudojama kitų rūšių, sudarytų iš bromo, gamybai. Pavyzdžiui, naudojant Finkelšteino reakciją, gaunami kai kurie didesnio reaktyvumo alkil-halogenidai, iš kurių vienas buvo gana naudojamas fotografijoje.
- Valymo ir dezinfekavimo srityje natrio bromidas naudojamas kartu su chloru didelių vandens kiekių, tokių kaip baseinai ir sūkurinės vonios, sanitarijai..
Nuorodos
- Vikipedija. (s.f.). Natrio bromidas. Gauta iš en.wikipedia.org
- PubChem. (s.f.). Natrio bromidas. Gauta iš pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Kvietimas į organinę chemiją. Gauta iš books.google.co.ve
- „Science Direct“. (s.f.). Natrio bromidas. Gauta iš sciencedirect.com
- Riviere, J. E. ir Papich, M. G. (2009). Veterinarinė farmakologija ir terapija. Gauta iš books.google.co.ve


