Cheminių lygčių metodų ir pavyzdžių balansavimas
The cheminių lygčių balansavimas reiškia, kad visi elementai, esantys minėtoje lygtyje, turi tokį patį atomų skaičių kiekvienoje pusėje. Siekiant šio tikslo, reikia naudoti balansavimo metodus, skirtus kiekvienai reakcijoje esančiai rūšiai tinkamus stechiometrinius koeficientus priskirti.
Cheminė lygtis yra tai, kas simboliais parodoma, kas vyksta cheminės reakcijos metu tarp dviejų ar daugiau medžiagų. Reagentai tarpusavyje sąveikauja ir, priklausomai nuo reakcijos sąlygų, kaip produktas bus gaunamas vienas ar daugiau skirtingų junginių..
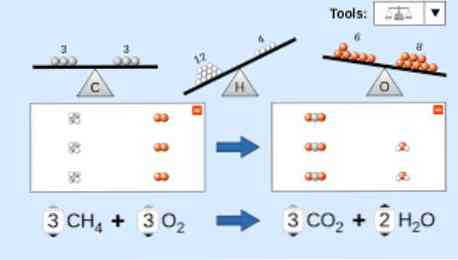
Apibūdinant cheminę lygtį, reikia atsižvelgti į šiuos dalykus: Pirma, reaguojančios medžiagos yra parašytos lygties kairėje pusėje, po kurios eina vienakryptis rodyklė arba dvi priešingos horizontalios rodyklės, priklausomai nuo reakcijos tipo. kailis.
Indeksas
- 1 Cheminių lygčių balansavimo metodai
- 1.1 Cheminių lygčių balansas pagal bandymus ir klaidas (taip pat vadinamas patikrinimu ar bandymu)
- 1.2 Cheminių lygčių algebrinė pusiausvyra
- 1.3 Redokso lygčių (jonų elektronų metodas) riedėjimas
- 2 Balansavimo cheminių lygčių pavyzdžiai
- 2.1 Pirmasis pavyzdys
- 2.2 Antrasis pavyzdys
- 2.3 Trečiasis pavyzdys
- 3 Nuorodos
Cheminių lygčių balansavimo metodai
Atsižvelgiant į tai, kad reagentai ir produktai yra žinomi, ir kad jų formulės yra teisingai išreikštos pusėje, kuri atitinka juos, mes toliau deriname lygtis pagal šiuos metodus.
Cheminių lygčių balansavimas pagal bandymus ir klaidas (taip pat vadinamas tikrinimu ar bandymu)
Jis pagrįstas reakcijos stechiometrija ir bando išbandyti skirtingus koeficientus, kad būtų galima subalansuoti lygtį, kol pasirenkami mažiausi įmanomi sveiki skaičiai, su kuriais abiejų pusių yra gaunamas vienodas kiekvieno elemento atomų skaičius reakcijos.
Reagento arba produkto koeficientas yra skaičius, kuris yra prieš jo formulę, ir tai yra vienintelis skaičius, kurį galima keisti lyginant lygtį, nes formulių poskyrių keitimas pakeistų junginio tapatybę aptariama.
Skaičiuokite ir palyginkite
Nustačius kiekvieną reakcijos elementą ir įdėjus jį į teisingą pusę, mes skaičiuojame ir palyginame kiekvieno lygtyje esančio elemento atomų skaičių ir nustatome tuos, kurie turi būti subalansuoti.
Tada toliau tęsiame kiekvieno elemento balansavimą (po vieną), pateikdami visus koeficientus prieš kiekvieną formulę, kurioje yra nesubalansuotų elementų. Dažniausiai metaliniai elementai yra subalansuoti, tada nemetaliniai elementai ir galiausiai deguonies ir vandenilio atomai.
Tokiu būdu kiekvienas koeficientas daugina visus ankstesnio formulės atomus; taigi, subalansuojant elementą, kiti gali nesubalansuoti, tačiau tai koreguojama, kai reakcija yra subalansuota.
Galiausiai, tai patvirtina paskutinis skaičius, kad visa lygtis teisingai subalansuota, tai yra, kad ji laikosi materijos išsaugojimo įstatymo.
Cheminių lygčių algebrinė pusiausvyra
Norėdami naudoti šį metodą, nustatoma procedūra, skirta cheminių lygčių koeficientams, kurie turi būti išspręsti, nežinomais..
Pirma, specifinis reakcijos elementas laikomas nuoroda, o koeficientai pateikiami kaip raidės (a, b, c, d ...), kurios atstovauja nežinomus, pagal kiekvieno elemento esamas atomas kiekvienoje molekulėje (jei rūšyje nėra šio elemento „0“).
Gavus šią pirmąją lygtį, nustatomos kitų reakcijoje esančių elementų lygtys; bus lygios lygtys, nes minėtoje reakcijoje yra elementų.
Galiausiai, nežinomieji nustatomi pagal vieną iš algebrinių redukcijos, išlyginimo ar pakeitimo metodų ir gaunami koeficientai, gaunantys teisingai subalansuotą lygtį.
Balansavimo redokso lygtys (jonų elektronų metodas)
Pirma, bendroji (nesubalansuota) reakcija yra patalpinta jonų pavidalu. Tada ši lygtis suskirstyta į dvi pusines reakcijas, oksidaciją ir redukciją, kiekvieną balansavimą pagal atomų skaičių, jų tipą ir jų mokesčius..
Pavyzdžiui, reakcijoms, kurios vyksta rūgščioje terpėje, pridedamos H molekulės.2Arba subalansuoti deguonies atomus ir pridėti H+ subalansuoti vandenilio atomus.
Priešingai, šarminėje terpėje pridedamas vienodas skaičius OH jonų- abiejų pusių lygtis kiekvienam H jonui+, ir kur atsiranda H jonų+ ir OH- jie susiburia, kad suformuotų H molekules2O.
Pridėti elektronų
Tada jūs turite pridėti tiek elektronų, kiek reikia balansuoti mokesčius, po to, kai subalansuojate kiekvieną pusinės reakcijos klausimą.
Po kiekvienos pusinės reakcijos sukimosi, jos pridedamos ir baigiamos baigiant galutinę lygtį bandymu ir klaidomis. Jei dviejų pusių reakcijų elektronų skaičius skiriasi, vienas arba abu turi būti padauginti iš koeficiento, kuris yra lygus šiam skaičiui.
Galiausiai, reikia patvirtinti, kad lygtis apima tą patį atomų skaičių ir tos pačios rūšies atomų skaičių, be to, jie turi tokius pat mokesčius abiejose pasaulinės lygties pusėse..
Balansuojančių cheminių lygčių pavyzdžiai
Pirmasis pavyzdys
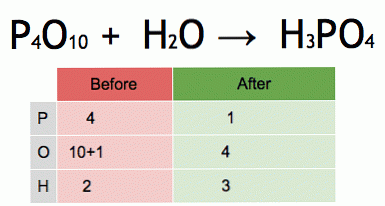
Tai yra subalansuotos cheminės lygties animacija. Fosforo pentoksidas ir vanduo paverčiami fosforo rūgštimi.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Antrasis pavyzdys
Jūs turite etano degimo reakciją (nesubalansuota).
C2H6 + O2 → CO2 + H2O
Naudojant bandymų ir klaidų metodą, kad būtų subalansuotas, pastebima, kad nė vienas iš elementų neturi vienodo skaičiaus atomų abiejose lygties pusėse. Taigi jis prasideda anglies balansu, pridedant du kaip stechiometrinį koeficientą, kuris pridedamas prie gaminio šono..
C2H6 + O2 → 2CO2 + H2O
Anglis buvo subalansuota abiejose pusėse, todėl mes tęsiame vandenilio pusiausvyrą, pridedant tris prie vandens molekulės.
C2H6 + O2 → 2CO2 + 3H2O
Galiausiai, kadangi lygiagretės pusėje yra septyni deguonies atomai ir tai yra paskutinis elementas, kuris dar turi būti subalansuotas, frakcinis skaičius 7/2 dedamas prieš deguonies molekulę (nors paprastai yra naudingi visi koeficientai)..
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Tada patikrinkite, ar kiekvienoje lygties pusėje yra toks pat anglies atomų (2), vandenilio (6) ir deguonies (7) skaičius.
Trečiasis pavyzdys
Geležies oksidacija dichromato jonais vyksta rūgščioje terpėje (nesubalansuota ir joninė forma)..
Tikėjimas2+ + Kr2O72- → Tikėjimas3+ + Kr3+
Taikant jonų elektronų metodą jo balansavimui, jis padalintas į dvi pusiau reakcijas.
Oksidacija: tikėjimas2+ → Tikėjimas3+
Sumažinimas: Cr2O72- → Kr3+
Kadangi geležies atomai jau yra subalansuoti (1: 1), produktų pusėje pridedamas elektronas, kad būtų subalansuotas įkrovimas.
Tikėjimas2+ → Tikėjimas3+ + e-
Dabar „Cr“ atomai yra subalansuoti, pridedant du lygius į dešinę pusę. Tada, kai reakcija vyksta rūgštinėje terpėje, pridedamos septynios H molekulės.2Arba gaminių pusėje subalansuokite deguonies atomus.
Kr2O72- → 2Cr3+ + 7H2O
Norint subalansuoti H atomus, pridedama keturiolika H jonų+ reagentų pusėje ir, išlyginus medžiagą, įkrovos yra subalansuotos pridėjus šešis elektronus toje pačioje pusėje.
Kr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Galiausiai pridedamos abi pusinės reakcijos, tačiau kadangi oksidacijos reakcijoje yra tik vienas elektronas, visa tai turi būti padauginta iš šešių.
6Fe2+ + Kr2O72- +14H+ + 6e- → Tikėjimas3+ + 2Cr3+ + 7H2O + 6e-
Galiausiai, elektronai turi būti pašalinti abiejose pasaulinės jonų lygties pusėse, patikrinant, ar jų įkrovos ir medžiagos yra teisingai subalansuotos.
Nuorodos
- Chang, R. (2007). Chemija (9-asis red.). McGraw-Hill.
- Hein, M., ir Arena, S. (2010). Kolegijos chemijos pamatai, pakaitinis. Gauta iš books.google.co.ve
- Tuli, G. D. ir Soni, P. L. (2016). Chemijos ar cheminių lygčių kalba. Gauta iš books.google.co.ve
- „Speedy Publishing“ (2015). Chemijos lygtys ir atsakymai (Greitieji studijų vadovai). Gauta iš books.google.co.ve


