Dvigubų pakaitinių reakcijų tipai ir pavyzdžiai
The dvigubos pakaitinės reakcijos, dvigubo poslinkio arba metatezės atveju, yra dvigubas jonų mainas tarp dviejų junginių, be jokių šių oksidacijos ar redukcijos. Tai viena iš svarbiausių cheminių reakcijų.
Naujas obligacijas sudaro didelės elektrostatinės traukos jėgos tarp jonų. Be to, reakcija skatina stabilesnių rūšių, pvz., Vandens molekulės, susidarymą. Bendroji dvigubos pakaitinės reakcijos cheminė lygtis iliustruojama apatinėje nuotraukoje.
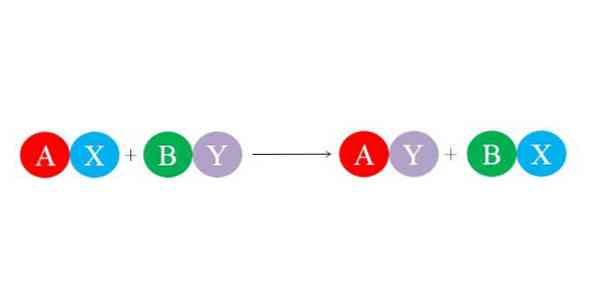
Pradiniai junginiai AX ir BY reaguoja keisdami „savo partnerius“ ir taip sudarant du naujus junginius: AY ir BX. Ši reakcija įvyksta, jei ir tik tada, kai A ir Y yra labiau susiję nei A ir B, arba jei BX nuorodos yra stabilesnės nei BY. Kadangi reakcija yra paprastas jonų mainas, nė vienas iš šių padidėjimų ar praranda elektronų (redokso reakcija).
Taigi, jei A yra įkrovos katijonas +1 junginyje AX, jis turi tą patį įkrovą +1 junginyje AY. Tas pats pasakytina ir apie kitus „laiškus“. Ši reakcija yra rūgšties ir bazės reakcijų palaikymas ir nuosėdų susidarymas.
Indeksas
- 1 tipai
- 1.1 Neutralizavimas
- 1.2 Krituliai
- 2 Pavyzdžiai
- 2.1 1 pavyzdys
- 2.2 2 pavyzdys
- 2.3 3 pavyzdys
- 2.4 4 pavyzdys
- 2.5 5 pavyzdys
- 2.6 6 pavyzdys
- 2.7 7 pavyzdys
- 2.8 8 pavyzdys
- 3 Nuorodos
Tipai
Neutralizavimas
Stipri rūgštis reaguoja su stipria baze, kad susidarytų tirpios druskos ir vanduo. Kai vienas iš dviejų - rūgšties arba bazės - yra silpnas, pagaminta druska nėra visiškai jonizuota; tai yra vandeninėje terpėje, galinčioje hidrolizuoti. Taip pat rūgštis arba bazė gali būti neutralizuoti druska.
Pirmiau minėtą gali vėl atstovauti cheminė lygtis su raidėmis AXBY. Tačiau, kadangi Brønsted rūgštingumą nurodo tik H jonai+ ir OH-, jie atvaizduoja A ir Y raides:
HX + BOH => HOH + BX
Ši cheminė lygtis atitinka neutralizaciją, kuri yra tiesiog reakcija tarp HX rūgšties ir BOH bazės, kad susidarytų HOH (H2O) ir BX druskos, kurios gali arba negali būti tirpios vandenyje.
Jūsų skeletas gali skirtis priklausomai nuo stechiometrinių koeficientų arba rūgšties pobūdžio (organinių ar neorganinių)..
Krituliai
Šio tipo reakcijoje vienas iš produktų yra netirpus terpėje, paprastai vandenyje, ir nusėda (kieta kieta medžiaga iš likusio tirpalo).
Schema yra tokia: du tirpūs junginiai, AX ir BY, sumaišomi ir vienas iš produktų, AY arba BX, nusodina, o tai priklausys nuo tirpumo taisyklių:
AX + BY => AY (s) + BX
AX + BY => AY + BX
Tuo atveju, kai AY ir BX netirpsta vandenyje, tos jonų poros, kurios turi stipriausią elektrostatinę sąveiką, nusodins, o tai gali būti kiekybiškai atspindėta jų tirpumo konstantų (Kps) vertėse..
Tačiau daugelyje nusėdimo reakcijų viena druska yra tirpus ir kiti nusodina. Abiejų reakcijų neutralizavimas ir nusodinimas gali atsirasti tame pačiame medžiagų mišinyje.
Pavyzdžiai
1 pavyzdys
HCl (ac) + NaOH (ac) => H2O (l) + NaCl (ac)
Kokios reakcijos tai yra? Druskos rūgštis reaguoja su natrio hidroksidu, todėl susidaro vanduo ir natrio chloridas. Kadangi NaCl yra labai tirpus vandeninėje terpėje, taip pat susidarė vandens molekulė, 1 pavyzdžio reakcija yra neutralizuojama.
2 pavyzdys
Cu (NE3)2(ac) + Na2S (ac) => CuS (s) + 2NaNO3(ac)
Šioje reakcijoje nėra H jono+ nei OH-, ir vandens molekulė nepastebima dešinėje cheminės lygties pusėje.
Vario (II) nitratas arba vario nitratas keičia jonus natrio sulfidu. Vario sulfidas yra netirpus, kitaip nei natrio nitratas, tirpsta druska.
Cu tirpalas (NO3)2 tai mėlyna, o Na2S yra gelsvas. Kai abu yra sumaišyti, spalvos dingsta ir CuS nusodina, o tai yra juoda kieta medžiaga.
3 pavyzdys
CH3COOH (ac) + NaOH (ac) => CH3COONa (ac) + H2O (l)
Vėlgi, tai yra dar viena neutralizavimo reakcija. Acto rūgštis reaguoja su natrio hidroksidu ir sudaro natrio acetato druską ir vandens molekulę.
Kitaip nei 1 pavyzdys, natrio acetatas nėra visiškai jonizuota druska, nes anijonas yra hidrolizuojamas:
CH3COO-(ac) + H2O (l) <=> CH3COOH (ac) + OH-(ac)
4 pavyzdys
2HI (ac) + CaCO3s) => H2CO3(ac) + CaI2(ac)
Šioje reakcijoje, nors ir neatrodo neutralizuojanti, hidroksi rūgštis visiškai reaguoja su kalkakmeniu, kad susidarytų anglies rūgštis ir kalcio jodidas. Be to, šilumos išsiskyrimas (egzoterminė reakcija) suyra anglies rūgštį į anglies dioksidą ir vandenį:
H2CO3(ac) => CO2(g) + H2O (l)
Pasaulinė reakcija lieka tokia:
2HI (ac) + CaCO3s) => CO2(g) + H2O (l) + CaI2(ac)
Be to, kalcio karbonatas, bazinė druska, neutralizuoja hidrodidinę rūgštį.
5 pavyzdys
AgNO3(ac) + NaCl (ac) => AgCl (s) + NaNO3(ac)
Sidabro nitrato jonai keičiasi natrio chloridu, taip sudarant netirpią sidabro chlorido druską (baltos nuosėdos) ir natrio nitratą.
6 pavyzdys
2H3PO4(ac) + 3Ca (OH)2(ac) => 6H2O (l) + Ca3(PO4)2(-ai)
Fosforo rūgštis neutralizuojama kalcio hidroksidu, todėl susidaro netirpi druskos kalcio fosfatas ir šeši moliai vandens molekulių.
Tai yra dviejų tipų dvigubos pakaitinės reakcijos pavyzdys: rūgšties neutralizavimas ir netirpios druskos nusodinimas.
7 pavyzdys
K2S (ac) + MgSO4(ac) => K2SO4(ac) + MgS (s)
Kalio sulfidas reaguoja su magnio sulfatu, S jonai susilieja tirpale2- ir Mg2+ sudaryti netirpią druskos magnio sulfidą ir tirpią druskos kalio sulfatą.
8 pavyzdys
Na2S (ac) + HCl (ac) → NaCl (ac) + H2S (g)
Natrio sulfidas neutralizuoja druskos rūgštį, susidaro natrio chloridas ir vandenilio sulfidas.
Šioje reakcijoje nėra vandens (skirtingai nei dažniausiai pasitaikančios neutralizacijos), bet ne elektrolitinė vandenilio sulfido molekulė, kurios kvapas supuvę kiaušiniai yra labai nemalonus. H2S išsilieja iš tirpimo dujinėje formoje, o likusi rūšis išlieka ištirpusi.
Nuorodos
- Whitten, Davis, Peck & Stanley. Chemija (8-asis red.). CENGAGE mokymasis, p 150-155.
- Quimicas.net (2018). Dvigubo keitimo reakcijos pavyzdžiai. Gauta 2018 m. Gegužės 28 d., Iš: quimicas.net
- Metatezės reakcijos. Gauta 2018 m. Gegužės 28 d., Nuo: science.uwaterloo.ca
- Khan akademija. (2018). Dvigubos pakaitinės reakcijos. Gauta 2018 m. Gegužės 28 d., Iš: khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (2016 m. Gegužės 8 d.). Dvigubo keitimo reakcijos apibrėžimas. Gauta 2018 m. Gegužės 28 d., Nuo: thinkco.com


