Magnio hidrido formulė, cheminė struktūra ir savybės
The magnio hidridas (MgH2 molekulinė formulė), yra cheminis junginys, kurio sudėtyje yra 7,66% masės vandenilio ir randamas kaip balta kristalinė kieta medžiaga. Jis daugiausia naudojamas kitoms cheminėms medžiagoms paruošti, nors jis taip pat buvo tiriamas kaip potencialus vandenilio laikymo terpė.
Jis priklauso fiziologinio tirpalo (arba jonų) hidridų grupei, apibrėžtai neigiamai įkrautam H-jonui. Laikoma, kad šie hidridai yra sudaryti iš šarminių metalų ir šarminių metalų, tačiau magnio (ir berilio) atveju, be tų jonų, kurios apibūdina šią hidridų šeimą, yra kovalentinių ryšių..
Indeksas
- 1 Paruošimas ir formulė
- 2 Cheminė struktūra
- 3 Fizinės ir cheminės savybės
- 3.1 Fizinis
- 3.2 Chemikalai
- 4 Naudojimas
- 4.1 Vandenilio saugojimas
- 4.2 Hidrinimo ir dehidrogenavimo reakcijos
- 4.3 Purvas
- 4.4 Kuro elementai
- 4.5 Transportas ir energetika
- 4.6 Alkilinimas
- 5 Rizika
- 5.1 Reakcija su vandeniu
- 5.2 Tai yra piroforinis
- 6 Nuorodos
Paruošimas ir formulė
Magnio hidridas susidaro tiesiogiai hidrinant magnio (Mg) metalą esant aukštam slėgiui ir temperatūrai (200 atmosferų, 500 ° C) su MgI katalizatoriumi2. Jo reakcija atitinka:
Mg + H2→ MgH2
Taip pat tirta MgH gamyba2 esant žemesnei temperatūrai, naudojant nanokristalinį magnį, gautą rutuliniuose malūnuose.
Taip pat yra ir kitų paruošimo būdų, tačiau jie yra sudėtingesnės cheminės reakcijos (magnio-antraceno hidrinimas, dietilmagnio ir ličio-aliuminio hidrido reakcija ir MgH komplekso produktas).2).
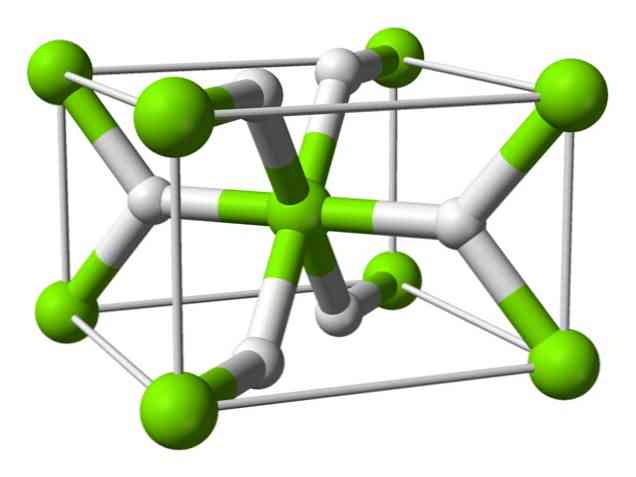
Cheminė struktūra
Šis atomas turi rutilo struktūrą kambario temperatūroje su tetragoniniu kristaliniu struktūru. Aukšto slėgio sąlygomis jis turi mažiausiai keturias skirtingas formas, taip pat pastebėta nestehiometrinė struktūra su vandenilio trūkumais; pastarasis susidaro tik labai mažais dalelių kiekiais, kai susidaro.
Kaip minėta pirmiau, ryšiai, egzistuojantys rutilo struktūroje, yra iš dalies kovalentinės savybės, o ne vien tik joninės, kaip ir kiti druskos hidridai..
Dėl to magnio atomas yra visiškai sferinis, tačiau jo hidrido jonas turi pailgos struktūros.
Fizinės ir cheminės savybės
Fizinis
- Išvaizda: balti kristalai.
- Molinė masė: 26,3209 g / mol
- Tankis: 1,45 g / cm3
- Lydymosi temperatūra: 285 ° C
- Tirpumas: Į vandenį skaidosi.
Šio cheminio junginio molekulinė masė yra 26,321 g / mol, tankis 1,45 g / cm3 ir jo lydymosi temperatūra yra 327 ° C.
Chemikalai
- Kitų cheminių medžiagų pirmtakas.
- Vandenilio saugojimas, kaip galimas energijos šaltinis.
- Redukuojanti medžiaga organinėje sintezėje.
Svarbu nurodyti, kad šis junginys negali būti patekęs į skystą būseną, o kai jis yra pernešamas arba lydomas arba įterpiamas į vandenį, jis skaidosi. Šis hidridas netirpsta eteryje.
Tai labai reaktyvi ir labai degi medžiaga, kuri taip pat yra piroforinė, ty ji gali spontaniškai užsidegti ore. Šios trys sąlygos yra saugumo rizika, kuri bus paminėta paskutiniame šio straipsnio skyriuje.
Naudojimas
Vandenilio saugojimas
Magnio hidridas lengvai reaguoja su vandeniu, kad susidarytų vandenilio dujos.
MgH2+2H2O → 2H2+Mg (OH)2
Be to, ši medžiaga suyra esant 287 ° C temperatūrai ir 1 baro slėgiui:
MgH2→ Mg + H2
Todėl siūloma naudoti magnio hidridą kaip vandenilio laikymo terpę, skirtą jos naudojimui ir transportavimui.
Siūlomas metalo magnio kiekio hidrinimas ir dehidrogenavimas kaip būdas transportuoti dujinį vandenilį, taip užtikrinant, kad jo transportavimo metu nebūtų nuotėkio ir būtų saugesnis bei praktiškesnis nei naudojant aukšto slėgio indus..
Hidrogenavimo ir dehidrogenavimo reakcijos
Nors magnio hidrido skilimo temperatūra yra jo naudojimo ribojantis veiksnys, buvo pasiūlyti metodai, kaip pagerinti hidrinimo ir dehidrogenavimo reakcijų kinetiką. Vienas iš jų yra magnio dalelių dydžio sumažinimas naudojant rutulinius malūnus.
Purvas
Be to, buvo pasiūlyta sistema, kuri gamina magnio hidridą purvo pavidalu (geriau valdoma ir saugesnė nei milteliuose ar kitose kietosiose dalelėse), kuri reaguotų su vandeniu, kad gautų norimą vandenilį..
Apskaičiuota, kad anksčiau minėtas dumblas susidarytų smulkiai sumalytu hidridu, apsaugotu apsauginiu aliejaus sluoksniu ir suspenduotu disperguojančiuose agentuose, siekiant užtikrinti, kad jis išlaiko nuoseklumą be medžiagos praradimo ir kad jis neprasiskverbia drėgmės iš aplinkos..
Šis dumblas turi pranašumą, nes jis gali būti pumpuojamas per bet kurį įprastą dyzeliną, benziną ar vandens siurblį, kad šis ekonominis pasiūlymas būtų veiksmingas ir efektyvus..
Kuro elementai
Magnio hidridas gali būti panaudotas pažangių kuro elementų gamyboje, taip pat baterijų ir energijos kaupimo srityje.
Transportas ir energija
Per pastaruosius dešimtmečius buvo atsižvelgta į vandenilio naudojimą kaip energijos šaltinį. Vandeniui implantuoti kaip kurą reikia surasti saugias ir grįžtamas saugojimo sistemas, kurių talpa yra didelė (vandenilio kiekis tūrio vienetui) ir gravimetrinis (vandenilio kiekis masės vienetui)..
Alkilinimas
Alkilinimas (pridėti CH alkilo grupes3R) organinių junginių bazinėje terpėje, kur yra -OH grupių esant mažai koncentracijai ir temperatūrai, aukštesnei už hidrido lydymosi tašką.
Šiuo atveju vandeniliai, esantys magnio hidriduose (MgH2), sujunkite -OH grupes, sudarančias vandenį. Laisvasis magnis gali gauti halogeną, kuris dažnai lydi alkilo molekulę, kuri yra skirta prisijungti prie angliavandenilių grandinės.
Rizika
Reakcija su vandeniu
Kaip jau minėta, magnio hidridas yra medžiaga, kuri labai lengvai ir smarkiai reaguoja su vandeniu ir suteikia galimybę sprogti didesnėmis koncentracijomis.
Taip atsitinka todėl, kad jos egzoterminė reakcija generuoja pakankamai šilumos, kad užsidegtų skilimo reakcijoje išleistos vandenilio dujos, todėl susidaro gana pavojinga grandinės reakcija..
Jis yra piroforinis
Magnio hidridas taip pat yra piroforinis, o tai reiškia, kad jis gali spontaniškai užsidegti esant drėgnam orui, ir sudaro magnio oksidą ir vandenį..
Jo įkvėpimas nerekomenduojamas kietoje būsenoje arba susilietus su garais: cheminė medžiaga ir jos skilimo produktai gali sukelti rimtus sužalojimus ar net mirtį.
Jis gali sukelti korozinius tirpalus, liečiančius vandenį, ir užteršti jį. Patekimas į odą ir akis nerekomenduojamas, taip pat sukelia gleivinės dirginimą.
Nebuvo įrodyta, kad magnio hidridas gali sukelti lėtinį poveikį sveikatai, pvz., Vėžį, reprodukcinius defektus ar kitas fizines ar psichines pasekmes, tačiau, dirbant su jais (ypač respiratoriais ar kaukėmis), rekomenduojama naudoti apsauginę įrangą. smulkių dulkių pobūdis).
Dirbant su šia medžiaga, oro drėgmė turi būti maža, užgesinti visus uždegimo šaltinius ir transportuoti juos į būgnus ar kitus konteinerius..
Visada turėtumėte vengti dirbti su didelėmis šios medžiagos koncentracijomis, kai to galima išvengti, nes sprogimo galimybė žymiai sumažėja.
Jei atsiranda magnio hidrido išsiliejimas, darbo zona turi būti izoliuota ir dulkės imamos dulkių siurbliu. Niekada nenaudokite sauso valymo metodo; padidina reakcijos su hidridu tikimybę.
Nuorodos
- Zumdahl, S. S. (1998). Encyclopedia Britannica. Paimta iš britannica.com.
- PubChem. (2005). „PubChem Open Chemistry“ duomenų bazė. Paimta iš pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). „Green Car Congress“. Paimta iš greencarcongress.com.
- Cheminės medžiagos, C. (n.d.). „Cameo Chemicals“. Paimta iš cameochemicals.noaa.gov.
- Services, N. J. (1987). Naujasis Džersis Sveikatos ir vyresniųjų paslaugų departamentas. Paimta iš nj.gov.


