Kalcio hidrido (CaH2) savybės, reaktyvumas ir panaudojimas
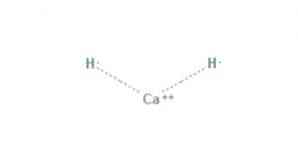
The kalcio hidridas yra cheminis junginys, kurio formulė CaH2, todėl jis yra šarminis žemės hidridas. Šis cheminis junginys turi dvi jonines jungtis tarp kalcio ir dviejų hidrido jonų, kaip parodyta 1 paveiksle.
Tai druskos hidridas, o tai reiškia, kad jo struktūra yra panaši į druską. Jo kristalinė struktūra yra tokia pati kaip švino chlorido (Cotunnite mineral), kaip parodyta 2 paveiksle.

Visi šarminiai ir šarminiai metalai sudaro hidrido druskas. Chemijoje hidridas yra vandenilio anijonas, H- arba, dažniau, junginys, kuriame vienas arba keli vandenilio centrai turi nukleofilines, redukuojančias arba pagrindines savybes..
Junginiuose, kurie laikomi hidridais, vandenilio atomas yra prijungtas prie daugiau elektropozicinio elemento arba grupės.
Jis gali būti gaunamas reaguojant kalcio ir vandenilio temperatūrai nuo 300 iki 400 ° C. Kitas būdas kalcio hidridui paruošti yra kalcio chlorido sušildymas kartu su vandeniliu ir natrio metalu. Reakcija vyksta taip:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Šioje reakcijoje kalcis (Ca) ir vandenilis (H) sukuria kalcio hidrido molekulę, o natrio atomai kartu su chloru sukuria natrio chlorido (NaCl) molekules..
Kalcio hidridą taip pat galima gaminti redukuojant kalcio oksidą (CaO) magniu (Mg). Reakcija vykdoma dalyvaujant vandeniliui. Ši reakcija taip pat gamina magnio oksidą (MgO). Toliau pateikiamas šios cheminės reakcijos formulė:
CaO + Mg + H2 → CaH2 + MgO
Indeksas
- 1 Kalcio hidrido fizinės ir cheminės savybės
- 2 Reaktingumas ir pavojai
- 3 Naudojimas ir sandėliavimas
- 4 Naudojimas ir taikymas
- 4.1 Nusausinimo priemonė
- 4.2 Vandenilio gamyba
- 4.3 Mažinimo agentas
- 5 Trūkumas naudojant kalcio hidridą
- 6 Nuorodos
Kalcio hidrido fizinės ir cheminės savybės
Kalcio hidridas yra kristalų, turinčių baltą ortorombinę struktūrą, rinkinys, kai jis yra grynas. Paprastai tai retai randama šioje formoje, todėl paprastai yra pilkai atspalvis. Jame nėra būdingo kvapo. Jo išvaizda parodyta 3 paveiksle (Royal Society of Chemistry, 2015).

Jo molekulinė masė yra 42 094 g / mol, jo lydymosi temperatūra yra 816 laipsnių Celsijaus ir tankis 1,70 g / ml. Jei jis ištirpsta vandenyje, jis reaguoja smarkiai gaminant vandenilį. Jis taip pat reaguoja su alkoholiu (Nacionalinis biotechnologijų informacijos centras., S.F.).
Reaktingumas ir pavojai
Kalcio hidridas yra stabili cheminė medžiaga, nors ji labai reaguoja į vandenį arba drėgmę. Susilietus su vandeniu ji išskiria degias vandenilio dujas, kurios gali užsidegti savaime.
Manoma sprogmenį junginys. Kai kaitinamas reakcijos su tetrahidrofurano, gali sukelti sprogimą. Jei jis sumaišomas su chlorato, hipochlorito, bromato, kalio perchlorato, tampa jautrūs šiluma, trintis ir yra sprogmuo (kalcio hidrido 7789-78-8, 2016).
Kai sidabro fluoridas yra susmulkintas kalcio hidridu, masė tampa kaitinama. Stiprus kaitinimas hidridu su chloru, bromu arba jodu sukelia įkaitinimą.
Hidrido mišiniai su įvairiais bromatais, pvz., Bario bromatu arba chloratais, pavyzdžiui, bario chloratu ir perchloratais, tokiais kaip kalio perchloratas, sprogsta. CaH2, esant trinčiai, reaguoja su sidabru fluoridu.
Šis junginys turi būti tvarkomas inertinėje atmosferoje. Jei tai nėra tinkamai tvarkoma, tai gali kelti rimtą grėsmę laboratorijų personalo, gelbėtojų ir cheminių atliekų tvarkytojų sveikatai ir saugai (UC centras laboratorijų saugai, 2013).
Ypač pavojinga sąlyčio su oda ar akimis atveju, nes ji dirgina. Labai pavojinga sąlyčio su oda atveju, nes ji gali būti ėsdinanti.
Jis taip pat yra pavojingas nurijus ir įkvėpus. Audinių pažeidimo dydis priklauso nuo kontakto ilgio. Patekimas į akis gali sukelti ragenos pažeidimą arba aklumą.
Kontaktas su oda gali sukelti uždegimą ir pūsles. Dulkių įkvėpimas sukels virškinimo trakto ar kvėpavimo takų dirginimą, kuriam būdingas deginimas, čiaudulys ir kosulys..
Sunkus per didelis poveikis gali sukelti plaučių pažeidimą, uždusimą, sąmonės netekimą ir net mirtį. Akies uždegimui būdingas paraudimas, dirginimas ir niežulys. Odos uždegimui būdingas niežulys, pilingas, paraudimas ar kartais pūslės.
Pakartotinis akių poveikis žemam kiekiui gali sukelti akių dirginimą. Pakartotinis poveikis odai gali sukelti vietinį odos naikinimą arba dermatitą.
Pakartotinis dulkių įkvėpimas gali sukelti įvairų kvėpavimo takų dirginimą ar plaučių pažeidimą. Pakartotinis arba ilgalaikis dulkių įkvėpimas gali sukelti lėtinį kvėpavimo takų dirginimą (medžiagos saugos duomenų lapas Kalcio hidrido MSDS, 2005).
Patekus į akis, jas reikia nedelsiant plauti dideliu kiekiu vandens mažiausiai 15 minučių, kartais pakeliant viršutinį ir apatinį voką..
Patekus ant odos, reikia nedelsiant skalauti dideliu kiekiu vandens mažiausiai 15 minučių, pašalinant užterštus drabužius ir batus.
Prarijus, vėmimo nereikėtų sukelti. Turėtų būti vadinamas nuodų kontrolės centras. Patartina išeiti iš parodos vietos ir nedelsiant persikelti į lauką.
Įkvėpus, jei sunku kvėpuoti, būtina tiekti deguonį. Kvėpavimas burnoje į burną neturėtų būti skiriamas, jei nukentėjusysis įkvėpus arba įkvėpė medžiagą.
Dirbtinis kvėpavimas turėtų būti sukurtas naudojant kišeninę kaukę, kurioje yra vienakryptis vožtuvas arba kitas tinkamas kvėpavimo takų medicinos prietaisas. Visais atvejais reikia nedelsiant kreiptis į gydytoją.
Naudojimas ir saugojimas
Junginys turi būti laikomas sausoje talpykloje nuo karščio. Jis turi būti laikomas atokiau nuo uždegimo šaltinių. Neįkvėpkite dulkių. Į šį produktą neturėtų būti pridedama vandens
Jei ventiliacija yra nepakankama, naudokite tinkamas kvėpavimo takų apsaugos priemones, pvz., Filtro kaukę. Poveikio atveju turėtumėte kreiptis į gydytoją ir, kiek įmanoma, parodyti etiketę. Vengti patekimo ant odos ir į akis.
Apšviestos medžiagos paprastai turėtų būti laikomos atskiroje apsaugos spintoje arba sandėliavimo patalpoje. Pakuotę laikyti sandariai uždarytą.
Laikyti vėsioje ir gerai vėdinamoje vietoje. Visi įrenginiai, kuriuose yra medžiagų, kad būtų išvengta elektros kibirkščių, turi būti įžeminti. Konteineris turi būti sausas ir vėsioje vietoje.
Tai yra nedegi medžiaga. Tačiau gaisrininkai privalo dėvėti atitinkamą įrangą, gesinant gaisrą aplink šį cheminį junginį.
Niekada patariama naudoti vandenį gesinti gaisrą aplink kalcio hidridą. Šiam tikslui gali būti naudojamas sausas smėlis, taip pat junginiai, tokie kaip natrio chloridas ir natrio karbonatas.
Norint pašalinti kalcio hidrido atliekas, jis turi būti išskaidytas įpilant 25 ml metanolio kiekvienam hidrido gramui azoto atmosferoje maišant.
Baigęs reakciją, tas pats vandens tūris yra įtraukta į srutų kalcio methoxide ir išmesti į kanalizaciją su vandeniu (Nacionalinė mokslinių tyrimų taryba, 1995).
Naudojimas ir taikymas
Dulkių agentas
Kalio hidridas yra santykinai lengvas sausiklis. Dėl šios priežasties šio junginio kaip sausiklio naudojimas yra saugesnis, palyginti su daugiau reaktyvių medžiagų, tokių kaip natrio-kalio ir natrio metalo lydiniai. Reaguoja su vandeniu taip:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Šios reakcijos hidrolizės produktai, vandenilis (dujos) ir Ca (OH) 2 (vandeninis mišinys) gali būti atskirti nuo cheminio tirpiklio po filtravimo, distiliavimo ar dekantavimo proceso..
Šis cheminis junginys yra efektyvus džiovintuvas daugeliui bazinių tirpiklių, tokių kaip aminai ir piridinas. Kartais jis naudojamas tirpikliams prieš išdžiovinant prieš naudojant daugiau reaktyvių sausiklių.
Vandenilio gamyba
1940-aisiais šis junginys buvo kaip vandenilio šaltinis „Hydrolith“ prekės ženklu..
Jis ilgą laiką buvo naudojamas kaip vandenilio šaltinis. Jis vis dar naudojamas gryno vandenilio gamybai įvairiose eksperimentuose, pažangių kuro elementų ir akumuliatorių programose (American Elements, S.F.).
Junginys buvo plačiai naudojamas dešimtmečius kaip saugi ir patogi oro oro balionų pripūtimo priemonė.
Lygiai taip pat laboratorijose ji reguliariai naudojama mažiems labai gryno vandenilio kiekiams gaminti. Dyzelino drėgmės kiekis apskaičiuojamas pagal vandenilį, susidariusį po gydymo CaH2.
Reduktorius
Šildant nuo 600 iki 1000 laipsnių Celsijaus, cirkonio oksidą, niobį, uraną, chromą, titaną, vanadį ir tantalą galima sumažinti, kad būtų paruošti šių metalų milteliai, kad kalcio hidridas galėtų būti naudojamas metalurgijoje. dulkių.
Toliau pateikta reakcija iliustruoja, kaip kalcio hidridas veikia kaip reduktorius:
TiO + 2CaH2 → CaO + H2 + Ti
Trūkumas naudojant kalcio hidridą
Šis cheminis junginys dažnai yra tinkamiausias pasirinkimas kaip džiovinimo agentas; Tačiau tai taip pat turi tam tikrų trūkumų:
-Šio junginio džiovinimo veiksmas yra lėtas, nes jis nėra tirpus jokiame tirpiklyje, su kuriuo jis neveikia smarkiai.
-Šis miltelinis junginys yra nesuderinamas su daugeliu tirpiklių. Jūsų reakcija su chloro angliavandeniliais gali sukelti sprogimus.
-Jis negali būti naudojamas tirpiklių dezinfekavimui, nes jis negali pašalinti ištirpusio deguonies.
-Kalcio hidrido ir kalcio hidroksido diferencijavimas yra gana sunkus dėl panašaus pasirodymo.
Nuorodos
- Amerikos elementai. (S.F.). kalcio hidridas. Gauta iš americanelements.com: americanelements.com.
- Kalcio hidridas 7789-78-8. (2016). Gauta iš chemijos knygos.com: chemicalbook.com.
- kalcio hidridas. (s.f.). Gauta iš chemijos mokinio: chemistrylearner.com.
- Medžiagos saugos duomenų lapas Kalcio hidrido MSDS. (2005 m. Spalio 10 d.). Gauta iš sciencelab.com: sciencelab.com.
- Nacionalinis biotechnologijų informacijos centras. (S.F.). „PubChem Compound“ duomenų bazė; CID = 105052. Gauta iš pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- Nacionalinė mokslinių tyrimų taryba. (1995). Protinga praktika laboratorijoje: chemikalų tvarkymas ir šalinimas. „Washinton“: „NationalAcademy Press“.
- Karališkoji chemijos draugija. (2015). kalcio hidrido ID 94784. Gauta iš chemspider.com: chemspider.com.
- UC centras laboratorijų saugai. (2013 m. Sausio 18 d.). standartinė veikimo procedūra kalcio hidridas. Gauta iš chemengr.ucsb.edu: chemengr.ucsb.edu.


