Cheminės aktyvacijos energija Kas tai sudaro, skaičiavimas
The cheminės aktyvacijos energija (kinetinių tyrimų požiūriu) nurodo kiek įmanoma mažiau energijos, reikalingos cheminei reakcijai pradėti. Pagal cheminės kinetikos susidūrimų teoriją sakoma, kad visos judančios molekulės turi tam tikrą kinetinę energiją.
Tai reiškia, kad kuo didesnis jūsų judėjimo greitis, tuo didesnis jūsų kinetinės energijos dydis. Šia prasme molekulė, kuri vykdo greitą judėjimą, negali būti padalinta į fragmentus, todėl turi susidaryti susidūrimas tarp jos ir kitos molekulės, kad galėtų įvykti cheminė reakcija..
Kai taip atsitinka, kai susidaro susidūrimas tarp molekulių, dalis jos kinetinės energijos transformuojama į vibracinę energiją. Taip pat, jei proceso pradžioje kinetinė energija yra didelė, susidūrime dalyvaujančios molekulės sukels tokią didelę vibraciją, kad kai kurios cheminės jungtys bus sugadintos..
Toks ryšių nutraukimas yra pirmas žingsnis reaguojant į produktus; tai yra, formuojant juos. Kita vertus, jei šio proceso pradžioje kinetinė energija yra nedidelė, atsiras fenomenas „molekulių atsitraukimas“, per kurį jie atskirs praktiškai nepažeistus..
Indeksas
- 1 Ką sudaro??
- 1.1 Aktyvintas kompleksas
- 2 Kaip tai apskaičiuojama?
- 2.1 Cheminės reakcijos aktyvinimo energijos apskaičiavimas
- 3 Kaip aktyvinimo energija veikia reakcijos greitį?
- 4 Aktyvinimo energijos skaičiavimo pavyzdžiai
- 5 Nuorodos
Ką ji sudaro??
Pradedant nuo molekulių susidūrimo koncepcijos, siekiant inicijuoti anksčiau aprašytas chemines reakcijas, galima teigti, kad susidaro mažiausias energijos kiekis, kad susidarytų susidūrimas.
Taigi, jei energijos vertė yra mažesnė už šį būtiną minimumą, po susidūrimo tiesiog nesikeis tarp molekulių, o tai reiškia, kad kai ši energija nėra, atitinkamos rūšys išlieka beveik nepažeistos ir neįvyks bet kokie pokyčiai dėl šio šoko.
Šioje idėjų eilutėje minimali energija, reikalinga pokyčiams, atsiradusiems po susidūrimo tarp molekulių, vadinama aktyvinimo energija.
Kitaip tariant, smūgio metu esančios molekulės turi turėti bendrą kinetinę energiją, kurios dydis yra lygus arba didesnis už aktyvinimo energiją, kad būtų galima įvykti cheminė reakcija..
Be to, daugeliu atvejų molekulės susiduria ir atsiranda dėl naujos rūšies, vadinamos aktyviuoju kompleksu, kuri taip pat vadinama „perėjimo būsena“, nes ji egzistuoja tik laikinai.
Jis susidaro dėl reaguojančių rūšių dėl susidūrimo ir prieš reakcijos produktų susidarymą.
Aktyvintas kompleksas
Pirmiau minėtas aktyvintas kompleksas sudaro labai mažą stabilumą turinčią rūšį, kuri, savo ruožtu, turi didelį potencialų energijos kiekį.
Toliau pateiktoje diagramoje parodyta reaktantų transformacija į produktus, išreikšta energija ir pažymint, kad susidariusio aktyvuoto komplekso energijos dydis yra žymiai didesnis nei reagentų ir produktų energijos kiekis..
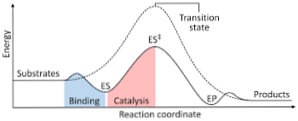
Jei reakcijos pabaigoje produktai turi didesnį stabilumą nei reaguojančios medžiagos, energijos išsiskyrimas vyksta šilumos pavidalu, suteikiant egzoterminę reakciją..
Priešingai, jei reaktyvai sukelia didesnį stabilumą nei produktai, tai reiškia, kad reakcijos mišinys pasireiškia energijos absorbcija šilumos pavidalu iš jo aplinkos, todėl susidaro endoterminė reakcija..
Lygiai taip pat, jei įvyksta vienas atvejis ar kitas, turi būti sukurta schema, tokia kaip anksčiau parodyta, kurioje pavaizduota sistemos, kuri reaguoja į reakcijos eigą ar pažangą, potencinė energija..
Tokiu būdu gaunami galimi energijos pokyčiai, atsirandantys, kai reakcija vyksta, ir reagentai paverčiami produktais.
Kaip tai apskaičiuojama?
Cheminės reakcijos aktyvinimo energija yra glaudžiai susijusi su šios reakcijos greičio konstanta, ir šios konstantos priklausomybė nuo temperatūros yra pavaizduota Arrhenius lygtimi:
k = Ae-Ea / RT
Šioje frazėje k reiškia reakcijos greičio konstantą (kuri priklauso nuo temperatūros) ir parametrą A tai vadinama dažnio koeficientu, ir tai yra molekulių tarpusavio susidūrimų dažnio matas.
Savo ruožtu, e išreiškia natūralių logaritmų serijos pagrindą. Jis padidinamas iki galios, lygios neigiamam aktyvacijos energijos koeficientui (Ea) tarp gaminio, susidariusio dėl dujų konstantos (\ tR) ir absoliučią temperatūrą (T).
Pažymėtina, kad dažnio koeficientas gali būti laikomas konstantu tam tikrose reakcijos sistemose plačiame temperatūros diapazone.
Ši matematinė išraiška iš pradžių buvo numatyta olandų kilmės chemikui Jacobui Henricui van't Hoffui 1884 m., Bet suteikusi jai mokslinį pagrįstumą ir aiškindama savo prielaidą, kad 1889 m..
Cheminės reakcijos aktyvinimo energijos apskaičiavimas
Arrheniaus lygtis nurodo tiesioginį proporcingumą, kuris egzistuoja tarp reakcijos greičio konstantos ir susidūrimų tarp molekulių dažnio.
Be to, šią lygtį galima pristatyti patogiau, taikant natūralių logaritmų savybę kiekvienai lygties pusei, gaunant:
ln k = ln A - Ea / RT
Pakeitus terminus, kad gautumėte linijos lygtį (y = mx + b), pasiekiama ši išraiška:
ln k = (- Ea / R) (1 / T) + ln A
Taigi, sudarant ln k ir 1 / T grafiką, gauname tiesią liniją, kur ln k reiškia y koordinates, (- A / R) reiškia linijos nuolydį (m), (1 / T) žymi x koordinates ir ln A reiškia sankirtą su ordinatų ašimi (b).
Kaip matyti, šio skaičiavimo rezultatas yra lygus -Ea / R. Tai reiškia, kad jei norima gauti aktyvinimo energijos vertę šia išraiška, turėtų būti atliktas paprastas kliringo rezultatas:
Ea = -mR
Čia mes žinome, kad m ir R vertė yra konstanta, lygi 8,314 J / K · mol.
Kaip aktyvinimo energija veikia reakcijos greitį?
Bandant sukurti aktyvinimo energijos vaizdą, jis gali būti laikomas barjeru, kuris neleidžia reaguoti tarp žemesnės energijos molekulių.
Kaip ir bendroje reakcijoje atsitinka, kad molekulių, kurios gali reaguoti, skaičius yra gana didelis, šių molekulių greitis - ir lygiaverčiai - kinetinė energija gali būti labai įvairi..
Paprastai atsitinka, kad tik nedidelė dalis molekulių, kurios susiduria su susidūrimu - tomis, kurios turi didesnį judėjimo greitį - pakankamai kinetinės energijos, kad galėtų įveikti aktyvinimo energijos dydį. Taigi šios molekulės yra tinkamos ir gali būti reakcijos dalis.
Pagal Arrheniaus lygtį neigiamas ženklas, kuris yra prieš aktyvacijos energijos ir dujų konstanta produkto santykį iki absoliučios temperatūros, reiškia, kad greičio konstanta mažėja, kai padidėja aktyvinimo energija, taip pat augimas, kai temperatūra pakyla.
Aktyvacijos energijos skaičiavimo pavyzdžiai
Norint apskaičiuoti aktyvinimo energiją, sudarant grafiką, pagal Arrhenius lygtį turime, kad acetaldehido skilimo reakcijos greičio konstantos būtų matuojamos penkiose skirtingose temperatūrose ir norime nustatyti aktyvinimo energiją reakcijai, kuri išreiškiama:
CH3CHO (g) → CH4(g) + CO (g)
Penkių matavimų duomenys yra tokie:
k (1 / M1/2S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Pirma, norint išspręsti šią nežinomą ir nustatyti aktyvinimo energiją, turime sukurti ln k vs 1 / T (y vs x) grafiką, kad gautumėte tiesią liniją ir iš čia paimkite šlaito ir suraskite Ea vertę. kaip paaiškinta.
Matavimų duomenų transformavimas pagal Arrhenius lygtį [ln k = (- Ea / R) (1 / T) + ln A] y ir x reikšmės yra tokios:
ln k: (-4,51) - (-3,35) - (-2,254) - (-1,070) - (-0,237)
1 / T (K-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Iš šių verčių ir matematiniu nuolydžio skaičiavimu - kompiuteriu arba skaičiuokle, išraiška m = (Y2-Y1) / (X2-X1) arba naudojant linijinį regresijos metodą - gauname, kad m = -Ea / R = -2,09 * 104 K. Taigi:
Ea = (8,314 J / K · mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Norėdami nustatyti kitas aktyvavimo energijas grafiniu būdu, atliekama panaši procedūra.
Nuorodos
- Vikipedija. (s.f.). Aktyvinimo energija. Gauta iš en.wikipedia.org
- Chang, R. (2007). Chemija, devintas leidimas. Meksika: McGraw-Hill.
- Britannica, E. (s.f.). Aktyvinimo energija. Gauta iš britannica.com
- Moore, J. W. ir Pearson, R. G. (1961). Kinetika ir mechanizmas. Gauta iš books.google.co.ve
- Kaesche, H. (2003). Metalų korozija: fizikocheminiai principai ir dabartinės problemos. Gauta iš books.google.co.ve


