Stiprus ir silpnas elektrolitai, skirtumai, pavyzdžiai
The elektrolitai jos yra medžiagos, kurios gamina elektrą laidų tirpalą, kai jis ištirpinamas poliniame tirpiklyje, pavyzdžiui, vandenyje. Ištirpintas elektrolitas yra atskiriamas į katijonus ir anijonus, kurie yra disperguoti minėtame tirpale. Jei tirpalui taikomas elektrinis potencialas, katijonai laikysis elektrodo, turinčio daug elektronų.
Priešingai, tirpale esantys anijonai susieti su elektriniu trūkumu. Medžiaga, kuri išskiria į jonus, įgyja gebėjimą atlikti elektros energiją. Dauguma druskų, rūgščių ir tirpių bazių yra elektrolitai.
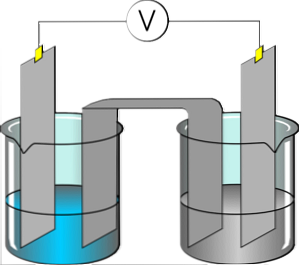
Kai kurios dujos, pavyzdžiui, vandenilio chloridas, gali veikti kaip elektrolitai tam tikromis temperatūros ir slėgio sąlygomis. Natrio, kalio, chlorido, kalcio, magnio ir fosfato pavyzdžiai yra geri elektrolitų pavyzdžiai.
Indeksas
- 1 Kas yra stiprūs ir silpni elektrolitai?
- 2 Skirtumai
- 3 Metodai elektrolitų identifikavimui
- 4 Stiprus ir silpnas elektrolitų pavyzdžiai
- 4.1 Stiprūs elektrolitai
- 4.2 Silpni elektrolitai
- 5 Nuorodos
Kas yra stiprūs ir silpni elektrolitai?
The stiprūs elektrolitai yra tie, kurie visiškai jonizuoja - tai yra, jie yra 100% atskirti, o silpni elektrolitai jie jonizuojasi tik iš dalies. Šis jonizacijos procentas paprastai yra apie 1–10%.
Siekiant geriau atskirti šiuos du elektrolitų tipus, galima teigti, kad stiprių elektrolitų tirpale pagrindinės rūšys (arba rūšys) yra gaunami jonai, o silpna elektrolito tirpalo pagrindinė rūšis yra pats junginys. jonizuoti.
Stiprūs elektrolitai skirstomi į tris kategorijas: stiprios rūgštys, stiprios bazės ir druskos; o silpni elektrolitai skirstomi į silpnas rūgštis ir silpnas bazes.
Visi joniniai junginiai yra stiprūs elektrolitai, nes jie išskiriami į jonus, kai jie ištirpsta vandenyje.
Netgi netirpūs joniniai junginiai (AgCl, PbSO4, CaCO3) yra stiprūs elektrolitai, nes nedideli vandenyje tirpstantys kiekiai yra daugiausia jonų pavidalu; tai reiškia, kad gautame tirpale nėra junginio formos ar kiekio.
Aukštesnėje temperatūroje lygiavertis elektrolitų laidumas mažėja, tačiau veikia priklausomai nuo jų stiprumo.
Stiprūs elektrolitai mažina jų laidumą esant didesnėms koncentracijoms, o silpni elektrolitai turi didelį laidumo greitį, esant didesnėms koncentracijoms..
Skirtumai
Svarbu žinoti, kaip atpažinti formulę ir pripažinti, kokioje klasifikacijoje jis yra (jonas ar junginys), nes tai priklausys nuo saugos standartų dirbant su chemikalais.
Kaip minėta anksčiau, elektrolitai gali būti identifikuojami kaip stiprūs arba silpni, priklausomai nuo jų jonizacijos pajėgumo, tačiau kartais tai gali būti akivaizdesnė, nei atrodo.
Dauguma rūgščių, bazių ir tirpių druskų, kurios neatitinka rūgščių arba silpnų bazių, laikomos silpnomis elektrolitais.
Iš tiesų reikia daryti prielaidą, kad visos druskos yra stiprūs elektrolitai. Priešingai, silpnos elektrolitai yra silpnos rūgštys ir bazės, be azoto turinčių junginių.
Elektrolitų nustatymo metodai
Yra būdų, kaip palengvinti elektrolitų identifikavimą. Toliau naudojamas šešių pakopų metodas:
- Ar jūsų elektrolitas yra vienas iš septynių stiprių rūgščių?
- Ar tai metalo forma (OH)n? Tada tai yra stipri bazė.
- Ar tai metalo forma (X)n? Tada tai yra druska.
- Ar jūsų formulė prasideda H? Tada tai tikriausiai yra silpna rūgštis.
- Ar jis turi azoto atomą? Tada tai gali būti silpna bazė.
- Nė vienas iš pirmiau minėtų sąlygų netaikomas? Tada tai nėra elektrolitas.
Be to, jei elektrolito reakcija atrodo tokia: NaCl (s) → Na+(ac) + Cl-(ac), kurioje reakcija ribojama tiesiogine reakcija (→), mes kalbame apie stiprų elektrolitą. Jei tai yra netiesioginis (↔), tai yra silpnas elektrolitas.
Kaip nurodyta ankstesniame skyriuje, elektrolito laidumas kinta priklausomai nuo koncentracijos tirpale, bet taip pat ši vertė priklauso nuo elektrolito stiprumo..
Esant didesnėms koncentracijoms, stiprūs ir tarpiniai elektrolitai reikšmingais intervalais nesumažės, tačiau silpnieji turės didelį sumažėjimą, kol didesnės koncentracijos vertės bus artimos nuliui..
Taip pat yra tarpinių elektrolitų, kuriuos galima išskirti tirpaluose, kuriuose yra didesnių procentų (mažiau nei 100%, bet daugiau kaip 10%), be ne elektrolitų, kurie tiesiog nesiskiria (anglies junginiai, tokie kaip cukrūs, riebalai ir alkoholiai)..

Stiprus ir silpnas elektrolitų pavyzdžiai
Stipri elektrolitai
Stiprios rūgštys:
- Perchloro rūgštis (HClO)4)
- Vandenilio bromido rūgštis (HBr)
- Druskos rūgštis (HCl)
- Sieros rūgštis (H) |2SO4)
- Azoto rūgštis (HNO)3)
- Periodinė rūgštis (HIO)4)
- Fluoroantimono rūgštis (HSbF)6)
- Magiškas rūgštis (SbF)5)
- Fluorosulfato rūgštis (FSO)3H)
Stiprios bazės
- Ličio hidroksidas (LiOH)
- Natrio hidroksidas (NaOH)
- Kalio hidroksidas (KOH)
- Rubidžio hidroksidas (RbOH)
- Cezio hidroksidas (CsOH)
- Kalcio hidroksidas (Ca (OH))2)
- Stroncio hidroksidas (Sr (OH)2)
- Bario hidroksidas (Ba (OH)2)
- Natrio amidas (NaNH)2)
Stiprūs pardavimai
- Natrio chloridas (NaCl)
- Kalio nitratas (KNO)3)
- Magnio chloridas (MgCl2)
- Natrio acetatas (CH3COONa)
Silpni elektrolitai
Silpnos rūgštys
- Acto rūgštis (CH3COOH)
- Benzenkarboksirūgštis (C) |6H5COOH)
- Skruzdžių rūgštis (HCOOH)
- Vandenilio cianidas (HCN)
- Chloracto rūgštis (CH2ClOOH)
- Jodo rūgštis (HIO)3)
- Azoto rūgštis (HNO)2)
- Anglies rūgštis (H) |2CO3)
- Fosforo rūgštis (H) |3PO4)
- Sieros rūgštis (H) |2SO3)
Silpnos bazės ir azoto junginiai
- Dimetilaminas ((CH3)2NH)
- Etilaminas (C) |2H5NH2)
- Amoniakas (NH3)
- Hidroksilaminas (NH2OH)
- Piridinas (C) |5H5N)
- Anilinas (C6H5NH2)
Nuorodos
- Stiprus elektrolitas. Gauta iš en.wikipedia.org
- Anne Helmenstine, P. (s.f.). Mokslo pastabos Gauta iš sciencenotes.org
- OpenCourseWare. (s.f.). UMass Bostonas. Gauta iš ocw.umb.edu
- Chemija, D. o. (s.f.). Šv. Olafo koledžas. Gauta iš stolaf.edu
- Anne Marie Helmenstine, P. (s.f.). ThoughtCo. Gauta iš thinkco.com


